Чем опасна вода с повышенным содержанием извести?
Излишне жесткая вода содержит практически нерастворимые соли кальция и магния. Это означает, что с вода большим содержанием извести не будет усваиваться организмом должным образом:
- постепенно оседая внутри почек и желчного пузыря, известковая вода вначале образует песок, позже — камни, требующие извлечения,
- возникновение склероза и артрита,
- обострение хронических заболеваний, связанных с другими органами желудочно-кишечного тракта,
- различные расстройства желудка и общее нарушение работы ЖКТ,
- ухудшение иммунитета,
- сухость и стянутость кожи (после умывания), шелушение вплоть до растрескивания, ломкость волос.
Не заметить излишнюю жесткость достаточно сложно. Вода с повышенным содержанием извести также оказывает негативный эффект на общий уровень жизни и комфорта, влияя на повседневные процессы:
- существенно ухудшает запах и вкус воды, чая и кофе, а также других напитков (вкус становится солоноватый или горьковатый, запахи — приглушенными),
- кипячение не решает вопрос — после него в воде плавают белые хлопья, плавно кочующие в чай и другие напитки, что также не особенно аппетитно,
- требуется значительный расход моющих средств, так как жесткая вода ухудшает пенообразование,
- овощи и мясо требуют увеличенного времени варки и могут быть более жесткими даже после долгой тепловой обработки.
Большое содержание извести в воде — методы борьбы
Известковая вода вредна для нашего здоровья, и, более того, также негативно влияет на состояние домашних питомцев. Если у домашнего животного обнаруживается мочекаменная болезнь, вполне возможно, что проблема не в корме, а чересчур жесткой воде.
Чтобы избавиться от извести в воде, необходимо выбрать фильтрационную установку. Оптимальным сочетанием цены, качества и компактности являются катионообменные умягчители TITANOF. Строго говоря, катионообменные фильтры не являются ими в известном смысле этого слова. В отличие от других примесей, соли жесткости сложно отфильтровать обычным образом, поэтому гораздо более эффективным методом является реакция ионного обмена. Ионы кальция заменяются ионами натрия, к содержанию которых в питьевой воде куда более щадящие требования. На выходе получается мягкая вода, готовая к употреблению.
Содержание:
В гидроксид кальция представляет собой неорганическое соединение, химическая формула которого Ca (OH)2. Это белый порошок, который использовался в течение тысяч лет, за это время он заработал несколько традиционных имен или прозвищ; Среди них можно назвать гашеную, мертвую, химическую, гашеную или мелкую известь.
В природе он доступен в виде редкого минерала того же цвета под названием портландит. Из-за этого Ca (OH)2 Его получают не напрямую из этого минерала, а в результате термической обработки с последующей гидратацией известняка. Из этого получается известь CaO, которую затем гасят или гидратируют с получением Ca (OH).2.

Са (ОН)2 это относительно слабая основа в воде, так как она плохо растворяется в горячей воде; но его растворимость увеличивается в холодной воде, потому что его гидратация экзотермична
Однако его основность по-прежнему является причиной осторожности при обращении с ним, так как он может вызвать ожог любой части тела
Он используется в качестве регулятора pH для различных материалов или продуктов, а также является хорошим источником кальция в отношении его массы. Он находит применение в бумажной промышленности, при дезинфекции сточных вод, в продуктах для депиляции, в продуктах питания из кукурузной муки.
Тем не менее, его наиболее часто применяли в качестве строительного материала, поскольку известь гидратируется при смешивании с другими ингредиентами в штукатурке или растворе. В этих затвердевших смесях Ca (OH)2 Он поглощает углекислый газ из воздуха, чтобы консолидировать кристаллы песка вместе с кристаллами, образованными из карбоната кальция.
В настоящее время все еще проводятся исследования с целью разработки лучших строительных материалов, содержащих Ca (OH).2 непосредственно в его составе в виде наночастиц.
Кристалл и его ионы
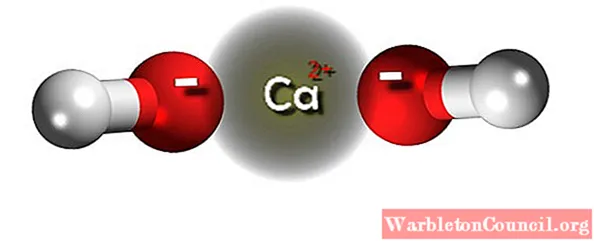
На верхнем изображении мы видим ионы, которые составляют гидроксид кальция. Его та же формула Ca (OH)2 указывает, что для каждого катиона Ca2+ есть два аниона ОН– которые взаимодействуют с ним посредством электростатического притяжения. В результате оба иона образуют кристалл с гексагональной структурой.
В таких гексагональных кристаллах Ca (OH)2 ионы расположены очень близко друг к другу, что создает впечатление полимерной структуры; хотя формальной ковалентной связи Ca-O нет, все же учитывая заметную разницу в электроотрицательности между двумя элементами.
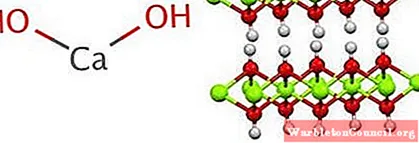
Структура порождает октаэдры CaO6, то есть Ca2+ взаимодействует с шестью ОН– (AC2+-ОЙ–).
Ряд этих октаэдров составляет слой кристалла, который может взаимодействовать с другим посредством водородных связей, которые поддерживают их межмолекулярную связь; однако это взаимодействие исчезает при температуре 580 ºC, когда Ca (OH) дегидратируется.2 к CaO.
Что касается высокого давления, то в этом отношении мало информации, хотя исследования показали, что при давлении 6 ГПа гексагональный кристалл претерпевает переход из гексагональной в моноклинную фазу; а вместе с тем деформация октаэдров CaO6 и его слои.
Физические свойства гидроксида кальция:
| Наименование параметра: | Значение: |
| Химическая формула | Ca(OH)2 |
| Синонимы и названия иностранном языке | calcium hydroxide (англ.)
известь гашенная (рус.) портландит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые гексагональные кристаллы |
| Цвет | белый |
| Вкус | жгучий |
| Запах | —* |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2211 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,211 |
| Температура разложения, °C | 580 |
| Молярная масса, г/моль | 74,093 |
| Растворимость в воде (20 oС), г/100 г | 0,16 |
* Примечание:
— нет данных.
Химические свойства [ | ]
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
CaSO4 v + 2H2O>>>»> Ca ( OH ) 2 + H 2 SO 4 ⟶ CaSO 4 ↓ + 2 H 2 O CaSO4 v + 2H2O>>>
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
CaCO3 v + H2O>>>»> Ca ( OH ) 2 + CO 2 ⟶ CaCO 3 ↓ + H 2 O CaCO3 v + H2O>>>
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
Ca(HCO3)2>>>»> CaCO 3 + H 2 O + CO 2 ⟶ Ca ( HCO 3 ) 2 Ca(HCO3)2>>>
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
H2>>>
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
CaSO3 v + 2NaOH>>>»> Ca ( OH ) 2 + Na 2 SO 3 ⟶ CaSO 3 ↓ + 2 NaOH CaSO3 v + 2NaOH>>>
Являясь сильным основанием, реагирует с солями аммония. Реакция происходит с образованием аммиака.
Источник
Получение
Са (ОН)2 Его получают в промышленных масштабах путем реакции извести, CaO, с двух-трехкратным избытком воды:
CaO + H2О => Са (ОН)2
Однако в процессе может происходить карбонизация Ca (OH).2, как описано выше.
Другие методы его получения — использование растворимых солей кальция, таких как CaCl.2 или Ca (NO3)2, и подщелачивают их NaOH, так что Ca (OH) осаждается2. Контролируя такие параметры, как объем воды, температура, pH, растворитель, степень карбонизации, время созревания и т.д., можно синтезировать наночастицы с различной морфологией.
Его также можно получить, выбрав натуральное и возобновляемое сырье или промышленные отходы, богатые кальцием, которые при нагревании и их зола будут состоять из извести; и отсюда снова можно получить Ca (OH)2 за счет гидратации этой золы без необходимости тратить известняк, CaCO3.
Например, для этой цели использовался жмых агавы, придавая добавленную стоимость отходам производства текилы.
Состав, подготовка, возникновение
СЭМ- изображение затвердевшего цементного теста с трещинами, на котором видны пластины гидроксида кальция и иглы эттрингита (микронный масштаб)
Гидроксид кальция имеет полимерную структуру, как и все гидроксиды металлов. Структура идентична Mg (OH) 2 ( структура брусита ); т.е. мотив йодида кадмия . Между слоями существуют сильные водородные связи .
Гидроксид кальция получают в промышленных масштабах путем обработки извести водой:
- СаО + Н 2 О → Са (ОН) 2
В лаборатории его можно приготовить, смешав водные растворы хлорида кальция и гидроксида натрия . Минеральная форма портландита относительно редка, но может быть найдена в некоторых вулканических, плутонических и метаморфических породах . Известно также, что он возникает при сжигании угольных отвалов.
Положительно заряженный ионизированный компонент CaOH + был обнаружен в атмосфере звезд S-типа .
Состав, подготовка, возникновение
SEM изображение трещиноватого затвердевшего цементного теста, на котором видны пластины гидроксида кальция и иглы эттрингит (микронная шкала)
Гидроксид кальция имеет полимерную структуру, как и все гидроксиды металлов. Структура идентична Mg (OH)2 (структура брусита); т.е. йодид кадмия мотив. Сильный водородные связи существуют между слоями.
Гидроксид кальция получают в промышленных масштабах путем обработки извести водой:
- CaO + H2О → Са (ОН)2
В лаборатории его можно приготовить путем смешивания водный решения хлорид кальция и гидроксид натрия. Минеральная форма, портландит, относительно редко, но его можно найти в некоторых вулканических, плутонический, и метаморфических пород. Известно также, что он возникает при сжигании угольных отвалов.
Положительно заряженные ионизированные частицы CaOH+ был обнаружен в атмосфере Звезды S-типа.
Рекомендации
- ↑ и
- рассчитывается молекулярная масса от .
- ↑ и
- Растворимость чистого лабораторного продукта в воде составляет около 1,85 г · л -1 при ° C ; 1,28 г · л -1 до 50 ° С ; 0,71 г · л -1 до 100 ° C .
- Инфобокс
- Известь остается, тем не менее, и, прежде всего, для каменщиков или профессионалов в строительных и конструкционных работах, гидравлической извести или вяжущим с гидравлическим отверждением, то есть с более или менее быстрым схватыванием с водой и, возможно, затем с воздухом. Идеальным раствором будет известь, которая почти мгновенно затвердеет в струе воды.
- отличие от последних, известь, полученная воздушной, воздушной известью или каменщиками и другими специалистами, — это прежде всего связующее на основе слабо увлажненной извести или известкового молока, которое более или менее медленно схватывается на воздухе, в частности, за счет карбонизации или фиксации углерода. диоксид.
- Европейский парламент и Совет Европы , » Директива 95/2 / ЕС , кроме красителей и подсластителей пищевых добавок » Официального журнала Европейского Союза , п о л 61,20 февраля 1995 г., стр. 1-56 .
- , стр. 1-35
- (in) Комиссия Codex Alimentarius , , GSFA Online на , Codex Alimentarius,2008 г.(доступ 3 октября 2008 г. )
Использует
Одним из важных применений гидроксида кальция является флокулянт, в воде и очистка сточных вод. Он образует рыхлое заряженное твердое вещество, которое помогает удалять из воды более мелкие частицы, в результате чего получается более чистый продукт. Это приложение стало возможным благодаря низкой стоимости и низкой токсичности гидроксида кальция. Он также используется при очистке пресной воды для повышения pH воды, чтобы трубы не подвергались коррозии там, где основная вода является кислой, потому что она саморегулируется и не слишком сильно повышает pH.
Он также используется при приготовлении газообразного аммиака (NH3), используя следующую реакцию:
- Са (ОН)2 + 2NH4Cl → 2NH3 + CaCl2 + 2H2О
Другое крупное применение — в бумажной промышленности, где он является промежуточным продуктом в реакции производства гидроксида натрия. Это преобразование является частью едкий шаг в для изготовления мякоти. В операции каустизации обожженная известь добавляется в зеленый ликер, который является решением в первую очередь карбонат натрия и сульфат натрия производится путем растворения нюхать, который представляет собой расплавленную форму этих химикатов из восстановительной печи.
Пищевая промышленность
Из-за его низкого токсичность и мягкость основных свойств гашеная известь широко используется в пищевая промышленность:
- В сертифицированном USDA производстве продуктов питания на растениях и в животноводстве
- Для очистки сырого сока от сахарный тростник или сахарная свекла в сахарная промышленность, (увидеть карбонизация )
- Обработка воды для алкогольных и безалкогольных напитков
- Соленый огурец огурцы и другие продукты
- Сделать китайский яйца века
- При подготовке кукурузы: удаляет целлюлозную оболочку зерен кукурузы (см. никстамализация )
- Чтобы очистить рассол из карбонаты кальция и магний при производстве соли для пищевой и фармацевтической промышленности
- Для обогащения (добавка кальция) фруктовых напитков, таких как апельсиновый сок, и детская смесь
- В качестве пищеварительной помощи (называется чуна, используется в Индии в паан, смесь орехи арека, гидроксид кальция и различные семена, завернутые в листья бетеля)
- В качестве замены пищевая сода в создании пападам
- При удалении углекислого газа из контролируемой атмосферы производят складские помещения.
Индейцы используют
Сухая необработанная кукуруза (слева) и обработанная кукуруза (справа) после кипячения в воде с гидроксидом кальция (15мл, или 1Лайм на 500 ст.г кукурузы) на 15 минут.
По-испански гидроксид кальция называется кал. Кукуруза, приготовленная с кал (в процессе никстамализация ) становится кореш (Никстамал), который значительно увеличивает биодоступность ниацина (витамина B3), а также считается более вкусным и легким для переваривания.
В жевании листья коки гидроксид кальция обычно жуют вместе, чтобы сохранить алкалоид стимуляторы химически доступен для поглощение телом. Точно так же коренные американцы традиционно жевали листья табака с гидроксидом кальция, полученным из обожженных раковин моллюсков, чтобы усилить эффект. Он также использовался некоторыми коренными американскими племенами в качестве ингредиента в йопо, психоделический табак, приготовленный из зерен некоторых Анаденантера виды.
Азиатские виды использования
Гидроксид кальция обычно добавляют в связку орех ареки и бетель лист называется ‘паан ‘сохранить алкалоид стимуляторы химически доступен для попадания в кровоток через сублингвальный абсорбция.
Он используется при изготовлении Насвар (также известен как насс или нисвар), тип табака для окунания, сделанный из свежих табачных листьев, гидроксида кальция (чуна или скоро) и древесной золы. Больше всего его потребляют в Патан диаспора Афганистан, Пакистан, Индия и Бангладеш. Жители также используют гидроксид кальция для красить свои дома из глины в Афганистане, Пакистане и Индии.
ГАШЕНАЯ ИЗВЕСТЬ: ЧТО ЭТО
Гашеная известь – это вещество, которое образуется при смешивании воды и оксида кальция. По-другому такая известь называется пушонкой. При получении гидратной извести выделяется такое количество энергии, которой бы хватило для закипания воды или возгорания дерева. Важную роль при образовании гашеного состава играет температура воды, с которой вступает в реакцию негашеная известь. Иногда данное вещество получается при горении угля.
Гашеная известь представляет собой порошок белого цвета. Иногда она имеет вид белых кристаллов, которые выдерживают воздействие довольно высоких температур, вплоть до 560 градусов. Однако если температура превышает это значение, то происходит обратный процесс распада на негашеную известь и воду. Состав не растворяется в спирте. Его химическая формула имеет следующий вид – Са (ОН) 2.
Как же из обычной извести получить гашеную известь? Все очень просто – ее нужно гасить водой. В процессе взаимодействия оксида кальция и воды получается известь гашеная пушонка. Если перевести все это в формулу, то выглядит она так:
CaО + H2O = Ca(OH)2
Гидратная известь добавляется в сухие строительные засыпки или используется как отличное средство для защиты от грызунов, насекомых и прочих вредителей. В погашенном состоянии материал отлично и без ограниченного срока может храниться в специальной яме. Примечательно, что за это время она не теряет своих свойств, а совсем наоборот. Качество материала будет только расти и улучшаться.
Сам процесс гашения извести можно проводить разными способами, все зависит от желаемого вида. Чтобы получилась пушонка, гашение выполняют на открытом и чистом воздухе или в яме или ящике (творильные емкости).
При этом на 1 т комовой извести приходится 700 л воды. Некоторые моменты приготовления зависят от скорости: во время процесса происходит выделение тепла, поэтому вода добавляется порциями, во избежание снижения температуры.
Получившееся тесто разбавляют водой, для получения густоты молока и все сливают в творильную емкость. В составе свежеприготовленной извести могут иметься остатки: пережженные или недожженные части исходного материала. Их все собирают и складывают в отельную емкость, после чего снова добавляют воду. Только после второго раза все остальное выбрасывают. Но что с ней делать дальше?
Химические свойства
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
- Ca(OH)2 + H2SO4 → CaSO4↓ + 2H2O .
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
- CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2 .
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
- Ca(OH)2 + CO →400oC CaCO3 + H2 .
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
- Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH .
Токсикологические свойства и характеристики
Показатели экотоксичности гидроксида кальция по отношению к живым организмам, низкие, реже умеренные, в частности:
- млекопитающие (острая оральная по виду крыса) – низкая;
- рыбы (острая 96 часовая по виду гамбузия обыкновенная) – низкая;
- почвенные черви (острая 14-дневная по виду дождевой червь) – умеренная.
Токсиколого-гигиеническая характеристика по отношению к человеку:
- канцерогенные свойства отсутствуют;
- о действии на эндокринную систему данных нет;
- о действии на репродуктивную систему данных нет;
- ингибирование ацетилхолинэстеразы не вызывает;
- нейротоксичностью не обладает;
- раздражает дыхательные пути;
- раздражает кожу;
- раздражает глаза;
- по мутагенности данных нет.
Переработка пищевых продуктов

Гидроксид кальция присутствует во многих продуктах на некоторых этапах их приготовления. Например, соленые огурцы, такие как корнишоны, опускают в водный раствор того же самого, чтобы сделать их более хрустящими, когда они залиты уксусом. Это потому, что белки на его поверхности поглощают кальций из окружающей среды.
То же самое происходит с кукурузными зернами перед их превращением в муку, так как это помогает им выделять витамин B.3 (ниацин) и облегчает измельчение. Кальций, который он обеспечивает, также используется для повышения питательной ценности некоторых соков.
Са (ОН)2 Он также может заменить разрыхлитель в некоторых рецептах хлеба и осветлить растворы сахара, полученные из сахарного тростника и свеклы.
Сфера применения известкового раствора
Гашеная известь благодаря своим свойствам обрела очень широкую сферу применения. Ее используют, как в личных целях многие люди, так и промышленности, как в строительстве различного рода объектов, так дезинфекции. Стоит выделить следующие конкретные способы применения данного вещества:
для побелки деревьев – известь позволяет защитить их от некоторого рода вредителей;

Побелка деревьев
при побелке внутренних помещений сооружений для проведения дезинфекции;

Проведение дезинфекции
для окрашивания деревянных изделий, чтобы продлить им срок эксплуатации, защитив таким образом от процессов гниения и возгорания;

Окрашивание деревянных поверхностей
для изготовления хлорки, применяемой преимущественно для дезинфекции;

Хлорка
в качестве связующего материала в различных строительных растворах. Здесь пропорции цементно известкового раствора для штукатурки;

Соединительный раствор
при изготовлении силикатного бетона. Здесь о расходе цемента на 1 куб бетона;

Силикатный бетон
для изготовления удобрений в землю, повышающих производительность урожая;

Удобрение
- для дубления кож, как один из компонентов технологического процесса;
- для нейтрализации повышенной кислотности в случаях применения в соединениях с Са;
- для изготовления пищевых добавок, прежде всего Е526;
- для обнаружения наличия углекислого газа;
- в изготовлении сахара, используя известковое молоко;
- при необходимости дезинфекции зубов в стоматологических клиниках.
Кроме вышеперечисленных сфер, натронная известь применяется еще со многими другими целями. Тут формула натронной извести. Прежде всего на это повлияли ее очень полезные свойства и технические характеристики.
Подробнее о применении извести смотрите на видео:
Красители (Е100 – Е199)
Их применяют, чтобы придать продукту определенный цвет или сделать его более насыщенным. Также их используют, когда нужно вернуть натуральный оттенок. Благодаря красителям производители делают товар более привлекательным.
Пищевые красители бывают натуральные и синтетические. Причем последние могут быть органические и неорганические.
Безопасные пищевые красители:
- куркумины: E100;
- рибофлавины: Е101;
- хлорофилл: Е140, Е141;
- сахарный колер: E150a, Е150b, Е150c, Е150d;
- уголь: E153;
- каротиноиды: E160a, Е160b, Е160c, Е160d, Е160e;
- лютеин: E161b;
- кантаксантин: E161g;
- бетанин: Е162;
- антоцианы: E163;
- карбонаты кальция: Е170;
- оксиды железа: Е172;
- серебро: Е174;
- золото: Е175;
- танины пищевые: Е181.
Пищевые красители низкой и средней опасности: E102, Е104, Е110, Е120-122, Е129, Е132, Е133, Е142, Е150-152, Е150d, Е155, Е160f, Е171.
Небезопасные: Е103, Е105, Е107, Е110, Е122, Е124, Е131.
Очень вредные: Е111, Е121, Е123, Е126, Е127, Е128, Е143, Е154.
Распространённые названия
- Гашёная и́звесть — название образуется благодаря способу получения: при получении основания, производится «гашение» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известко́вое молоко́ — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известко́вая вода́ — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- И́звесть-пушо́нка — при «гашении» негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Запрещенные добавки в России
За использование добавок в России отвечает Роспотребнадзор и Минздрав. На данный момент в списке запрещенных восемь добавок:
1. Е121
Синтетический красный краситель и канцероген. Способен развивать онкологию, негативно влияет на мочеполовую и дыхательную системы.
2. Е123
Красный амарант — канцероген, который способствует развитию злокачественных опухолей и негативно воздействует на течение беременности.
3. Е128
Краситель 2G содержит ядовитое ароматическое вещество анилин. Он нарушает память, координацию движений и ослабляет нервную систему.
4. Е216 (консервант пропилпарабен)
Пропилпарабен — сильный аллерген, который может быть причиной рака груди у женщин и бесплодия у мужчин.
5. Е240
Формальдегид — токсичный консервант, очень вредный для человека. Отравление проявляется упадком сил, затрудненным дыханием, иногда потерей сознания. Может провоцировать онкологические заболевания.
6. Е217
Натриевая соль особенно опасна для астматиков и людей с аллергией. Возможны нарушения процессов пищеварения, развитие злокачественных новообразований и головная боль.
7. Е924а
Бромат калия — канцероген, который провоцирует развитие злокачественных опухолей. Оказывает негативное влияние на мочевыделительную систему.
8. Е924b
Бромат кальция способствует развитию онкологических заболеваний. За счет сильных окислительных свойств токсичен при попадании на кожу и слизистые оболочки.
Использует
Если известь негашеная CaO берет на себя большинство рабочих мест в сталелитейной промышленности, общественных работах и дорогах (осушение основания пути со времен римской античности), водоочистке и сельском хозяйстве, строительстве и строительстве, гашеная известь используется как агент абсорбции диоксида углерода будь то в экстренной анестезии и дыхательном аппарате, а также в пище.
Гидроксид кальция — это пищевая добавка ( E526 ), которая используется в качестве регулятора pH и упрочнения / стабилизатора во многих продуктах.
Известь также используется в производстве промышленных смазок.
Ретроградная растворимость
Растворимость гидроксида кальция при 70 ° C составляет примерно половину от его значения при 25 ° C. Причина этого довольно необычного явления заключается в том, что растворение гидроксида кальция в воде является экзотермическим процессом, а также придерживается Принцип Ле Шателье. Таким образом, снижение температуры способствует устранению тепла, выделяемого в процессе растворения, и увеличивает константу равновесия растворения Ca (OH).2, и, таким образом, увеличивают его растворимость при низкой температуре. Эта противоречащая интуиции температурная зависимость растворимости упоминается как «ретроградная» или «обратная» растворимость. Вариативно гидратированные фазы сульфат кальция (гипс, бассанит и ангидрит ) также обладают ретроградной растворимостью по той же причине, поскольку их реакции растворения экзотермичны.
Структура, подготовка, возникновение [ править ]
СЭМ- изображение затвердевшего цементного теста с трещинами, на котором видны пластины гидроксида кальция и иглы эттрингита (микронный масштаб)
Гидроксид кальция имеет полимерную структуру, как и все гидроксиды металлов. Структура идентична Mg (OH) 2 ( структура брусита ); т.е. мотив йодида кадмия . Между слоями существуют сильные водородные связи .
Гидроксид кальция получают в промышленных масштабах путем обработки извести водой:
- СаО + Н 2 О → Са (ОН) 2
В лаборатории его можно приготовить, смешав растворы хлорида кальция и гидроксида натрия . Минеральная форма портландита относительно редка, но может быть найдена в некоторых вулканических, плутонических и метаморфических породах . Известно также, что он возникает при сжигании угольных отвалов.
Положительно заряженный ионизированный компонент CaOH + был обнаружен в атмосфере звезд S-типа .
Растворимость воды
Растворимость Ca (OH)2 в воде он уменьшается с повышением температуры. Например, при 0ºC его растворимость составляет 1,89 г / л; при 20ºC и 100ºC они составляют 1,73 г / л и 0,66 г / л соответственно.
Это указывает на термодинамический факт: гидратация Ca (OH)2 является экзотермическим, поэтому согласно принципу Ле Шателье уравнение будет выглядеть следующим образом:
Са (ОН)2 <=> Ca2+ + 2OH– + Q
Где Q — выделенное тепло. Чем горячее вода, тем больше будет равновесие влево; то есть меньше Ca (OH) будет растворяться2. Именно по этой причине в холодной воде растворяется намного больше, чем в кипящей.
С другой стороны, указанная растворимость увеличивается, если pH становится кислым из-за нейтрализации ионов ОН.– и смещению переднего равновесия вправо. При этом выделяется даже больше тепла, чем в нейтральной воде. Помимо кислых водных растворов, Ca (OH)2 он также растворим в глицерине.