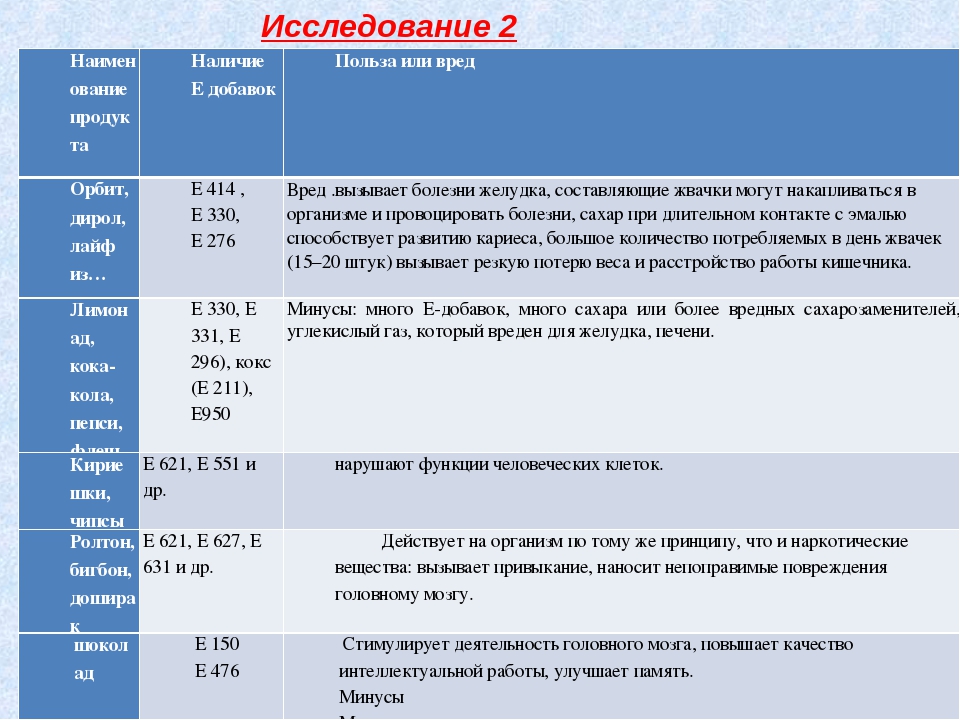
Области применения
NaOH очень активно используется в большом количестве сфер промышленности:
- Применяется для изготовления целлюлозы, картона, бумаги;
- Используется при производстве мыла, шампуня, моющих средств;
- Для очищения работ из стали от жировых и масляных компонентов;
- В химической промышленности для использования в химических реакциях;
- Для производства биодизеля, который является альтернативой дизельному топливу;
- Он эффективен для устранения засоренных канализационных труб;
На что обратить внимание в составе зубной пасты?
- В гражданской обороне для очистки воздуха и нейтрализации токсических веществ;
- В текстильной промышленности – для улучшения качества тканей;
- В пищевой промышленности с его помощью очищают овощи и фрукты от шкурки, используют для производства некоторых продуктов (например, шоколада, какао, мороженого, хлебобулочных изделий), а также в качестве пищевой добавки Е524.
- При проявлении фотографий;
- В косметологии.
Диагностика
Одним из ключевых методов как определить кислотность желудка, является проведение дыхательного уреазного теста на выявление бактерии Хеликобактер Пилори. Также, выполняется ПЦР и ИФА исследования, направленные на выявление антител к данному микроорганизму. К другим обязательным методам исследования при подозрении на гастрит с повышенной кислотностью, относят:
- Эндоскопическое исследование желудка (гастроскопия).С помощью данного метода оценивается состояние желудка, пищевода и двенадцатиперстной кишки. При необходимости, во время обследования, ведется забор фрагментов слизистой оболочки (биопсия).
- Внутрижелудочная pН-метрия. Для проведения исследования используется pН-метрический трансназальный зонд, который соединён с автономным регистрирующим блоком. Если показатели pН желудочного содержимого составляют менее 1,5 единиц, то диагноз гиперацидного гастрита подтверждается.
В качестве вспомогательных методов обследования может быть назначено ультразвуковое исследование органов брюшной полости.
Применение
Молочнокислый натрий широко применяется в пищевой, косметической и фармацевтической промышленности благодаря своим антиоксидантным и консервирующим свойствам.
В пищевой промышленности
Как консервант лактат натрия практически незаменим в таких продуктах, как:
- все изделия в вакуумной упаковке (мясо, колбасы, сосиски, сыры);
- эмульсионные ликеры, кремы и коктейли на их основе;
- консервированные овощи (в том числе огурцы, томаты, маслины, оливки и лук);
- тесто и хлебобулочные изделия, а также мука;
- кондитерские изделия (варенье, джем, сухое печенье, карамель);
- супы быстрого приготовления, соусы, бульонные кубики.
Помимо функции консерванта, лактат натрия может служить также стабилизатором, влагоудерживающим агентом и фиксатором окраски и быть использованным при производстве колбасных изделий, сгущённого молока и сыров, в том числе плавленых.
Лактат натрия безопасен даже для детского питания, поэтому неудивительно, что в составе сухих молочных смесей для детей от 0 лет он присутствует.
Производство косметики
Косметическая индустрия использует лактат натрия в виде 40-80% раствора:
- в средствах для увлажнения кожи;
- для снижения липкости и жирности кремов, эмульсий и лосьонов;
- как антисептическое средство для лечения проблем кожи, в том числе угревой сыпи и прыщей;
- для предотвращения усыхания мыла, придания ему гладкости, а также усиления твердости и увеличения сроков годности товара.
Регулярное потребление косметики с лактатом натрия обеспечивает коже гладкость и упругость, разглаживает морщины и предотвращает преждевременное старение.
Применение молочнокислого натрия в зубных пастах помогает сохранить чистоту зубов и слегка отбеливает зубную эмаль.
Лекарственные препараты
Молочная кислота нашла широкое применение в медицине. В условиях стационара лактат натрия используется при шоке, кровопотере, ожоговой болезни, для повышения давления крови при гипотоническом кризе, при операциях на сердце с применением искусственного кровообращения, в качестве противоядия при отравлении метиловым спиртом.
Он способен оказывать положительное влияние на сердечно-сосудистую систему, на органы дыхания, на кровообращение, проявлять дезинтоксикационное действие, способствовать повышению диуреза, улучшать функции печени и почек.
Сельское хозяйство
Молочнокислый натрий применяют в животноводстве для ухода за крупным рогатым скотом, в частности, для лечения кетоза у коров.
Другое
Лактат натрия также применяется в металлургии в растворах химического лужения меди и медных сплавов, в качестве влагоудерживающего агента при производстве табачных изделий, а также в качестве регулятора кислотности в чистящих и моющих средствах.
Влияние на организм
Добавка е325 относится к нулевому классу токсичности и применима даже в детском питании в качестве регулятора кислотности. В других же своих ипостасях лактат натрия запрещен к использованию при производстве сухих молочных смесей из-за отсутствия в детской печени специальных ферментов, которые благоприятствуют усвоению молочной кислоты.
Польза
Так как лактат натрия входит в состав микрофлоры нашего кишечника, при поступлении его в организм происходит нормализация той самой микрофлоры.
Вред
Единственный вред от добавки е325 связан с тем, что она синтетическая. Соответственно, возможно либо наличие в ней вредных примесей, либо изготовление лактата натрия из генномодифицированного сырья. Однако ни то ни другое наукой пока не изучено в должной мере, и о каком-то конкретном вреде для здоровья человека говорить не представляется возможным.
Средство для уборки санитарных помещений 750 мл GRASS DOS-GEL, щелочное, концентрат, гель
| Наличие на складе в Санкт-Петербурге | 25 шт. |
| Удаленный склад (срок поставки от 5–6 рабочих дней, закажите не менее 2 шт.) | +1227 шт. |
- Сопутствующие товары
- Аналоги
- Подробнее о товаре
- Обзоры 1
- Отзывы
- Госзакупка малого объема
- Характеристики
- Назначение — для уборки туалетов и ванных комнат.
- Серия — нет.
- Эффект от использования — отбеливание, очищение поверхности, удаление запаха.
- Профессиональное средство — да.
- Подходит для поверхностей — кафель, пластик, фаянс.
- Объем/ вес — 750 мл/ г.
- Форма выпуска — гель.
- Содержит — хлор.
- pH — 0.
- Дозатор — «утёнок».
- Упаковка — флакон.
- Производитель — Россия
- Вес с упаковкой — 879 г
- Размер в упаковке — 28.9×9.3×5.6 см
Универсальный чистящий гель для дезинфекции и отбеливания. Идеально подходит для чистки унитазов, ванн, раковин, кафеля, стоков, сливов, пола и рабочих поверхностей.
Обладает дезинфицирующими свойствами, удаляет плесень и грибок. Пары средства защищают от «летающих» микробов. Густая формула позволяет средству дольше оставаться на стенках, продолжая работать.
не менее 30% очищенная вода; не более 5%: гипохлорит натрия, анионные ПАВ, неионогенные ПАВ, гидроксид натрия, ароматизирующая добавка.
Полы и рабочие поверхности — концентрат разбавляется в пропорции 1:80 или 60 мл на 5 л воды. Отбеливание (ручная стирка) — концентрат разводится в пропорции 1:350 или 15 мл на 5 л воды. Замочить белье на 45 мин., затем тщательно прополоскать. Для замачивания на ночь сократить дозу в 2 раза.
Источник
Реакции
Если гидроксид натрия хранится в открытом виде на воздухе , он реагирует с диоксидом углерода с образованием гидрокарбоната натрия или карбоната натрия , поэтому его хранят в герметичных контейнерах .
- NаОЧАС(s)+С.О2(грамм)⟶ NаЧАСС.О3(s){\ Displaystyle \ mathrm {NaOH _ {(s)} + CO_ {2 (г)} \ longrightarrow \ NaHCO_ {3 (s)}}}
- 2NаОЧАС(s)+С.О2(грамм)⟶ Nа2С.О3(s)+ЧАС2О{\ displaystyle \ mathrm {2 \; NaOH _ {(s)} + CO_ {2 (g)} \ longrightarrow \ Na_ {2} CO_ {3 (s)} + H_ {2} O}}
В лаборатории аммиак можно легко получить путем кислотно-щелочной реакции из гидроксида натрия и хлорида аммония .
- NаОЧАС(s)+NЧАС4-йС.л(s)⟶NЧАС3(грамм)+NаС.л(s)+ЧАС2О(л){\ displaystyle \ mathrm {NaOH _ {(s)} + NH_ {4} Cl _ {(s)} \ longrightarrow NH_ {3 (g)} + NaCl _ {(s)} + H_ {2} O _ { (l)}}}
В виде раствора он реагирует с алюминием (с образованием диоксида алюминия-натрия ) и многими другими металлами, такими как железо , медь , кадмий , кобальт и титан .
- 2 А.л+2 NаОЧАС+2 ЧАС2О⟶2 NаА.лО2+3 ЧАС2{\ Displaystyle \ mathrm {2 \ Al + 2 \ NaOH + 2 \ H_ {2} O \ longrightarrow 2 \ NaAlO_ {2} +3 \ H_ {2}}}
Гидроксид натрия реагирует с кислотами с образованием солей , причем выделение тепла настолько велико, что с сильными кислотами, например Б. при капании концентрированной серной кислоты на порошкообразный гидроксид натрия происходит взрыв .
Нормы pH мочи
Как и в случае с любым другим тестом, у анализа мочи есть свои стандарты. Описанный в этой статье тест определяет pH мочи.
pH мочи колеблется от 0 до 7; нейтральный — значение принимает pH мочи 7 или щелочной. Тогда значения начинаются с pH мочи 7 и заканчиваются на pH мочи 14.
В случае pH мочи он также бывает кислым, нейтральным. В этом исследовании значения, которые не должны беспокоить, несколько ограничены. Они не имеют того же диапазона, что и весь диапазон pH, и колеблются только в пределах диапазона pH мочи 4,5 — pH 8 мочи. Диапазоны реакции основаны на шкале кислотности-щелочности (pH).
Но зачем вообще проверять pH мочи и что на основании этого можно сделать?
Анализы мочи и, в частности, pH мочи могут предоставить много информации, в том числе:
- потенциальные нарушения обмена веществ;
- гормональные нарушения (особенно у женщин);
- инфекции;
- дефицит или избыток калия чаще всего связаны с текущим питанием, но иногда и с серьезными заболеваниями;
Что такое гидроксид натрия
Это соединение – едкая щелочь, которая применяется не только пищевой, фармацевтической и косметической сферами, но и химической промышленностью. Гидроокись натрия, или каустическая сода, выпускается в виде немного скользких твердых гранул желтоватого или белого цвета. При сильной концентрации NaOH разъедает органические соединения, поэтому способен вызвать ожог. Используется как пищевая добавка Е524, необходимая для поддержания консистенции продуктов.
Формула
Вещество имеет химическую формулу NaOH. Соединение взаимодействует с различными веществами любых агрегатных состояний, нейтрализуя их, с кислотами, образуя соль и воду. Реакция с атмосферными оксидами и гидроксидами позволяет получить тетрагидроксоцинкат или алкоголят. Едкий натр применяется для осаждения металлов. Например, при реакции с сульфатом алюминия образуется его гидроксид. Осадок не растворяется и не наблюдается избыточное получение щелочи. Это актуально при очистке воды от мелких взвесей.
Свойства
Соединение растворяется в воде. Технический Sodium Hydroxide представляет собой водный раствор гидроксида натрия в щелочеустойчивой герметичной таре. При взаимодействии с водой каустик выделяет большое количество тепла. Вещество имеет следующие свойства:
- при предварительном расплавлении разрушает стекло, фарфор;
- взаимодействие с аммиаком вызывает пожароопасную ситуацию;
- кипит при 1390°С, плавится, если температура достигает 318°С;
- не растворяется в эфирах, ацетоне;
- очень гигроскопичен (поглощает пары воды из воздуха), поэтому натриевая щелочь должна храниться в сухом месте и герметичной упаковке;
- растворяется в метаноле, глицерине, этаноле;
- бурно взаимодействует с металлами – оловом, гидроксидом алюминия, свинцом, цинком, образует водород – взрывоопасный горючий яд;
- поглощает углекислый газ из воздуха.
Получение
Каустическая сода встречается в составе минерала брусита. Второе по величине месторождение сконцентрировано на территории России. Гидроокись благодаря исследованиям Николы Леблана, проведенным в 1787 г., получают методом синтеза из хлористого натрия. Позже востребованным способом добычи стал электролиз. С 1882 г. ученые разработали ферритный метод получения в лаборатории гидроксида с помощью кальцинированной соды. Электрохимический способ сейчас самый популярный: ионы натрия образуют его раствор едкой ртути – амальгаму, которая растворяется водой.
Общая информация
В 80% случаев, причиной развития воспалительного процесса с повышенной кислотностью желудка, является микроорганизм Хеликобактер Пилори, которая нарушает естественные защитные свойства желудка и приводит к повреждению эпителия органа. Гастрит с повышенной кислотностью может развиваться у людей независимо от возраста, в том числе у детей.
К другим факторам, предрасполагающим к развитию данного состояния, можно отнести:
- Регулярное воздействие стресса на организм.
- Нерациональное питание, преобладание в рационе жареной и жирной пищи, а также блюд, приготовленных во фритюре.
- Злоупотребление так называемыми перекусами.
- Длительное или бесконтрольное использование препаратов из группы нестероидных противовоспалительных средств. Частое употребление слишком горячей или слишком холодной пищи. Кроме того, высокая предрасположенность к развитию гиперацидного гастрита имеется у людей с заболеваниями щитовидной железы, сахарным диабетом и подагрой.
Чем опасна повышенная кислотность
Желудочный сок содержит соляную кислоту, которая необходима для расщепления компонентов пищи. Для того чтобы кислотная среда не повреждала стенки желудка, вырабатывается защитная слизь. При повышенной кислотности желудка наблюдается разрушение слизистого защитного слоя, с последующим формированием воспалительного процесса, образованием эрозий и язв.
Клинические симптомы
Воспалительное поражение органа с увеличением секреции желудочного сока чаще обостряется в период межсезонья, в осенние или весенние месяцы. К симптомам повышенной кислотности желудка можно отнести:
- Тянущая или схваткообразная боль в подложечной области, которая чаще усиливается после приема пищи. При остром течении воспалительного процесса, боль может сопровождаться рвотой, которая приносит временное облегчение.
- Изжога, которая вызвана забросом кислотного содержимого желудка в пищевод.
- Отрыжка кислым.
- Неприятный запах изо рта.
- Расстройства стула в виде запоров или диареи.
К другим симптомам повышенной кислотности желудка при гастрите относится слабость, головокружение, повышенная потливость, избыточное газообразование в кишечнике (метеоризм), усиленное слюноотделение, повышение или снижение аппетита, появление белого или серого налёта на поверхности языка. Пониженная кислотность желудка сопровождается такими симптомами, как уменьшение аппетита, ощущение тяжести в эпигастрии, отрыжка тухлым.
Рынок каустической соды
В России, согласно ГОСТ 2263-79, производятся следующие марки натра едкого:
- ТР — твёрдый ртутный (чешуированный);
- ТД — твёрдый диафрагменный (плавленый);
- РР — раствор ртутный;
- РХ — раствор химический;
- РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Ещё раз про онлайн
Тенденция к росту спроса на БАД зародилась давно. Доля биодобавок в парафармацевтической части аптечного ассортимента медленно, но верно растёт почти целое десятилетие. Девять лет назад, в 2012 году, она составляла около одной пятой — 21,2 %. А сейчас на неё приходится значительно более четверти — 28,7 %. Получается, пандемия и экономический кризис «придали ускорение» уже имеющимся трендам — как и в случае с онлайн-сегментом лекарственного обращения.
Кстати, об интернете. По данным DSM Group, на аптечные сайты приходится 11 % продаж БАД, на маркетплейсы — ещё 6 %. «Биодобавки становятся частью культуры здорового образа жизни. Их аудитория молодеет», — комментирует Наталья Прокопьева, председатель совета директоров «Эвалар». Если в 2018 году среди покупателей данной продукции преобладали представители старшего возраста, то уже с 2019 года картина меняется: добавки активно приобретают во всех возрастных группах.
По рублёвым объёмам реализации в интернете БАД к пище находятся на третьем месте — после изделий медицинского назначения и селективной косметики. Ассортимент маркетплейсов в значительной степени отличается от аптечного: здесь можно встретить такие наименования и таких производителей, которые в аптеках не представлены.
«В последнее время на поисковых сайтах отмечен кратный рост запросов по тематике „купить витамины“», — замечает Мария Русинова, коммерческий директор «ФармОушен Лаб».
«В сегменте „электронной коммерции“ витамины и минералы растут быстрее всех остальных категорий, — комментирует Юлия Родкина, директор по маркетингу компании „Промис“. — При этом самыми значимыми факторами выбора являются совет врача, собственный опыт и цена продукта».
Таким образом, основные тренды онлайна схожи с аптечными. Но подчеркнём, что отличается и ассортимент, и аудитория компаний-производителей.
Свойства гидроксида натрия
Формула гидроксида натрия представляет собой NaOH. Это неорганическое химическое соединение, очень сильное основание с pH = 14. Распространенное название гидроксида натрия — каустическая сода или сода. Чистое соединение — белое твердое вещество, скользкое на ощупь, в форме пастилок, драже. NaOH хорошо растворяется в воде. 50 процентов раствор гидроксида натрия является содовым щелоком, широко используемым в промышленности.
Эта жидкость не имеет цвета, запаха и не воспламеняется. Свойства NaOH делают его опасным веществом в чистом виде и в концентрированных растворах. Обладает сильным едким эффектом, вызывает химические ожоги, гигроскопичен, что заставляет его впитывать воду при контакте с кожей, создавая трудно заживающие раны.
Вдыхание пыли или паров гидроксида натрия вызывает жжение в носу и горле и слезящиеся глаза. Вредность гидроксида натрия наибольшая при непосредственном контакте с кожей и другими тканями. Его проглатывание может вызвать ожоги стенок пищеварительного тракта, что может привести к перфорации, кровоизлиянию и даже смерти.
Производство
Гидроксид натрия можно получить в лаборатории путем реакции карбоната натрия с гидроксидом кальция с образованием гидроксида натрия и карбоната кальция :
- Nа2С.О3+С.а(ОЧАС)2⟶2NаОЧАС+С.аС.О3{\ displaystyle \ mathrm {Na_ {2} CO_ {3} + Ca (OH) _ {2} \ longrightarrow 2 \; NaOH + CaCO_ {3}}}
Слаборастворимый карбонат кальция отфильтровывают. Легко растворимый гидроксид натрия остается в фильтрате. Этот процесс причинно-следственной связи ранее проводился в промышленных масштабах и сегодня снова вызывает интерес.
Другой метод — это сильно экзотермическая реакция элементарного натрия с водой с образованием едкого натра и водорода :
- 2Nа(s)+2ЧАС2О(л)⟶2NаОЧАС(аq)+ЧАС2(грамм){\ Displaystyle \ mathrm {2 \; Na \; _ {(s)} + 2 \, H_ {2} O \; _ {(l)} \ longrightarrow 2 \; NaOH \; _ {(aq)} + H_ {2} \; _ {(g)}}}
Этот эксперимент часто показывают в школах, чтобы продемонстрировать реакционную способность щелочных металлов с водой.
После испарения раствора гидроксида натрия остается твердый гидроксид натрия:
- NаОЧАС(аq)⟶NаОЧАС(s){\ Displaystyle \ mathrm {NaOH \; _ {(водный)} \ longrightarrow NaOH \; _ {(s)}}}
Процесс Акер для производства гидроксида натрия пути расплавленных солей электролиза из хлорида натрия был разработан Чарльз Эрнест Акером (1868-1920) в Соединенных Штатах Америки.
электролиз
→ Основная статья : Хлорно-щелочной электролиз
Гидроксид натрия получают промышленно с помощью электролиза из хлорида натрия с образованием каустической соды , водород и газообразный хлор :
- 2NаС.л(s)+2ЧАС2О(л)⟶С.л2(грамм)+ЧАС2(грамм)+2NаОЧАС(аq){\ Displaystyle \ mathrm {2 \; NaCl \; _ {(s)} + 2 \, H_ {2} O \; _ {(l)} \ longrightarrow Cl_ {2} \; _ {(g)} + H_ {2} \; _ {(g)} + 2 \; NaOH \; _ {(водн.)}}}
Для этого есть три различных технологических процесса :
- Мембранный процесс
Общими для всех процессов являются стадии дополнительной очистки и концентрирования с целью получения безводного гидроксида натрия.
Поскольку спрос на хлор прекратился с 1980 — х годов , каустическая сода , которая не побочным продуктом из хлорно-щелочного электролиза , больше не полностью покрывает мировой спрос, что делает каустификации интересным снова.
Описание
Трифосфат натрия и калия — неорганическое соединение . В международной классификации указана как добавка Е451, относящаяся к группе загустителей и эмульгаторов. Другие названия вещества: триполифосфат натрия, натриевая соль фосфорной кислоты, STTP (sodium tripolyphosfate)
Триполифосфаты производятся промышленным способом — синтезом из смеси солей фосфорных кислот. В реакциях получения участвуют элементы натрий и калий. В результате образуются два вида соли: натриевая, обозначаемая как Е451i, и калиевая — E451ii. Для их синтеза используют несколько разных смесей. В промышленности больше применяют натриевую соль фосфорной кислоты, она считается более безопасной.
Поэтому под обозначением «Е451 пищевая добавка» чаще всего подразумевают именно соединение натрия с фосфатами.
Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
- с кислотами, амфотерными оксидами и гидроксидами
c кислотами — с образованием солей и воды:
-
- NaOH + HCl → NaCl + H2O
-
- NaOH + H2S → NaHS + H2O (кислая соль, при отношении 1:1)
-
- 2NaOH + H2S → Na2S + 2H2O (в избытке NaOH)
Общая реакция в ионном виде:
-
- OH− + H+ → H2O
с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
-
- 2NaOH + ZnO →ot Na2ZnO2 + H2O — при сплавлении
-
- 2NaOH + ZnO + H2O → Na2[Zn(OH)4] — в растворе
- с амфотерными гидроксидами
-
- NaOH + Al(OH)3 →ot NaAlO2 + 2H2O — при сплавлении
-
- 3NaOH + Al(OH)3 → Na3[Al(OH)6] — в растворе
- с солями в растворе
-
- 2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
- c неметаллами
например, с фосфором — с образованием гипофосфита натрия:
- 4P + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
с серой:
-
- 3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
- с галогенами
-
- 2NaOH + Cl2 → NaClO + NaCl + H2O (дисмутация хлора при комнатной температуре)
-
- 6NaOH + 3Cl2 → NaClO3 + 5NaCl + 3H2O (дисмутация хлора при нагревании раствора)
- с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
-
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
- с эфирами, амидами и алкилгалогенидами (гидролиз):
Гидролиз эфиров
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
- с многоатомными спиртами — с образованием алкоголятов:
-
- HOCH2CH2OH + 2NaOH → NaOCH2CH2ONa + 2H2O
Откладывается ли диоксид титана в органах?
В 2016 году EFSA опубликовало обзор, в котором говорилось, что диоксид титана очень плохо всасывается и почти без потерь выводится с фекалиями. Тогда же организация заявила, что доказательства генотоксичности и канцерогенности не выявлены. Однако позже оказалось, что около 0,01% красителя задерживают иммунные клетки кишечника в его лимфоидных тканях. Гипотетически, диоксид титана может «добираться» до других органов. Однако как это может отразиться на здоровье, неизвестно.
Еще одно из опасений EFSA состоит в том, что есть подозрение, что потенциально диоксид титана может быть нейротоксичным и вызывать воспаление.
В некоторых исследованиях на животных ученые обнаруживали отложения Е171 в печени, почках и селезенке лабораторных животных. Однако в таких экспериментах использовали очень высокие концентрации вещества, которые не используют в пище. Возможен ли такой эффект у людей, сейчас неизвестно.
Диоксиду титана посвящено много исследований, большинство из них не обнаруживало вредных эффектов. Однако среди них было очень мало длительных исследований с участием людей. Таким образом, сегодня практически нет серьезных доказательств опасности этого красителя при использовании в пище. Но его исследование продолжается.