Использование свойств аммониевой соли в промышленности
Хлорид аммония – не самая популярная пищевая добавка, впрочем, он всё равно используется для приготовления некоторых видов продуктов. Его добавляют в муку и тесто для улучшения их текстуры и придания её однородности. Кроме того, Е510 можно найти в составе такой пищи и напитков:
- макаронных изделий;
- кондитерской продукции;
- плодовых и ягодных вин;
- дрожжей.
Скандинавские страны пользуются свойствами добавки для изготовления лакричных конфет (это, кстати, одна из причин, почему ими нельзя увлекаться – при переедании лакрицы могут появиться тошнота и рвота именно из-за хлорида аммония). В Норвегии вещество известно как приправа к различным блюдам.
Различные сферы производства, кроме пищевой, тоже применяют аммониевую соль:
- в металлургии для травления металлов;
- для защиты древесины от паразитов в сфере деревообработки;
- как реагент для опытов в химической промышленности;
- фармацевтическая отрасль для производства некоторых лекарств;
- для удаления оксидной плёнки в процессе пайки при сборке радиотехники;
- в пиротехнической промышленности как дымообразователь;
- в качестве азотного удобрения для сельского хозяйства;
- как фиксаж для фотоснимков в процессе фотопечати.
Виноделы пользуются порошковой формой добавки в качестве подкормки для дрожжевой среды зреющих вин. Всего 0,3 грамма раствора на 1 литр напитка вносится не чаще, чем раз в месяц для того, чтобы вино могло перебродить до нужного состояния.
Техническая соль аммония, которая продаётся в аптеках, может быть полезной и в быту: его раствор хорошо выводит загрязнения с одежды, мебели, украшений, посуды и бытовой техники.
приложений
1- Медицина
Хлорид аммония выполняет очень важную биохимическую функцию: он поддерживает физиологический уровень pH.
Как кислотная соль, она может помочь исправить ситуации, в которых концентрация хлорид-ионов в плазме низкая или в случаях алкалоза крови (высокий уровень pH крови). Это может произойти после рвоты, всасывания (удаления) содержимого желудка, использования диуретиков (таблеток с водой или жидкостью) или при некоторых заболеваниях желудка..
Хлорид аммония также вызывает выведение излишков солей и воды через мочеиспускание и вызывает ацидоз в моче (делает его более кислым).
Хлорид аммония также используется для уменьшения отека или увеличения веса, которое происходит до менструации, и в качестве помощи при лечении инфекций мочевыводящих путей (Университет Юты, 2017).
Это компонент многих лекарств от простуды и кашля из-за его эффективности в качестве отхаркивающего средства. В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец (Encyclopædia Britannica, 2016).
2- Удобрения
Хлорид аммония в основном используется в качестве источника азота в удобрениях (что соответствует 90% мирового производства соединения), таких как хлораммонийфосфат, в основном для выращивания риса и пшеницы в Азии..
3- Металлургия
Хлорид аммония используется в качестве флюса при изготовлении металлов, которые должны быть покрыты оловом, оцинкованы или сварены. Он работает как флюс, очищая поверхность заготовок, реагируя с оксидами металлов на поверхности, образуя летучий хлорид металла..
Для этого он продается в блоках в хозяйственных магазинах для использования при чистке наконечника паяльника и может быть включен в припой в виде флюса..
4- компонент батареи
Хлорид аммония, NH4Cl, является компонентом сухих батарей, энергетических резервуаров, которые питают электрические устройства. Батареи позволяют вам использовать электричество, когда вы не находитесь рядом с электрической розеткой или розеткой.
Для каждой батареи есть три основных компонента: катод (верхняя часть вашей обычной батарейки АА, из которой текут электроны), анод (нижняя часть батареи АА, в которую текут электроны) и электролит для через которые могут двигаться электроны и ионы.
Когда хлорид аммония используется в качестве электролита в батарее, он превращается в водную пасту и помещается между катодом и анодом.
Химические реакции между катодами батареи и анодами заставляют электроны протекать через пасту из хлорида аммония от катода к аноду.
Электроны проходят через металлические контакты в батарейном отсеке, заставляя электрическое оборудование работать (American Chemistry Council, Inc., 2005).
5- Еда
В некоторых странах хлорид аммония, под названием соль аммиака или разговорно сальмиакки, используется в качестве пищевой добавки под номером E E510, обычно в качестве дрожжевого питательного вещества при производстве хлеба.
Это пищевая добавка для крупного рогатого скота и ингредиент в питательной среде для дрожжей и многих микроорганизмов.
Хлорид аммония используется для придания вкуса темным конфетам, называемым соленой солодкой (очень популярным в скандинавских странах), для выпечки, чтобы дать бисквитам очень хрустящую текстуру, а в ликере Salmiakki Koskenkorva для ароматизации..
В Индии и Пакистане его называют «ношадер» и используют для улучшения свежести бутербродов, таких как самоса и джалеби.
6- Другое использование
Хлорид аммония можно найти в шампунях, красках и отбеливателях для волос, средствах для мытья и очищения тела, моющих средствах для лица, кондиционере, моющем средстве для мытья посуды, а также в маслах и солях для ванн..
Хлорид аммония также используется в травлении при изготовлении печатных плат, таких как огнетушитель. Он также является компонентом фейерверков, взрывчатых веществ и спичек, а также отвердителем в клеях на основе формальдегида..
Описание пищевой добавки
Хлорид аммония (пищевая добавка E-510) – белый кристаллический порошок, не имеющий запаха, хорошо растворим в воде.
Химическая формула: NH4Cl.
Водные растворы хлорида аммония имеют слабокислую реакцию. Получают это вещество химическим путем – пропусканием оксида углерода(IV) через раствор аммиака и хлорида натрия.
В природе нашатырь встречается в виде набольших корочек и налетов, вместе с серой, в пещерах, трещинах земной коры и около вулканов. Кроме того, это природный продукт разложения мочи и испражнений животных. Сами слова «соли аммония» пошли от храма, построенного в честь бога Аммония, где поклоняющиеся ему в ходе своих ритуалов нюхали нашатырь, что бы впасть в блаженный экстаз. Чуть позже нашатырь очень впечатлил алхимиков, которые обожествляли дым, даваемый реакциями с нашатырем. Они считали, что это два духа различных веществ высвободились и борются, проливая свою «кровь» — белый дым.
Реакции
Хлорид аммония пиролизуется и превращается в дым хлорида аммония после охлаждения.
Хлорид аммония, кажется, возгоняется при нагревании, но на самом деле разлагается на аммиак и газообразный хлористый водород .
- NH 4 Cl → NH 3 + HCl
Хлорид аммония реагирует с сильным основанием, таким как гидроксид натрия , с выделением газообразного аммиака:
- NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Точно так же хлорид аммония также реагирует с карбонатами щелочных металлов при повышенных температурах, давая аммиак и хлорид щелочного металла:
- 2 NH 4 Cl + Na 2 CO 3 → 2 NaCl + CO 2 + H 2 O + 2 NH 3
5% -ный по весу раствор хлорида аммония в воде имеет pH в диапазоне от 4,6 до 6,0.
Некоторые реакции хлорида аммония с другими химическими веществами являются эндотермическими, например, его реакция с гидроксидом бария и его растворение в воде.
Воздействие вещества на человека
Самое известное свойство соли аммония – возбуждающее. При потере сознания вдыхаемые пары раствора вещества способны оказать сильный стимулирующий эффект на дыхательные центры и привести человека в чувство.
Лучшие материалы месяца
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
Кроме того, добавка обладает мочегонным свойством и может применяться для борьбы с отёчностью и застоями жидкости. В таком случае предписывают принимать слабый раствор вещества в очень маленьких количествах. Добавка всасывается организмом из пищеварительного тракта и выводится почками вместе со всей лишней жидкостью. Для тех, кто имеет в анамнезе заболевания почек, приём вещества категорически запрещён.
Также хлорид аммония оказывает отхаркивающее действие при сильном кашле, вызванном хроническим бронхитом, бронхиальной астмой или пневмонией.
Вдыхание большого количества паров добавки Е510 крайне опасно, так как может спровоцировать ожог дыхательных путей и остановку дыхания. Передозировка раствором аммониевой соли вызывает неприятные симптомы отравления: тошноту, рвоту и потерю аппетита.
В некоторых государствах использование этой пищевой добавки под запретом. В России, Украине и многих странах Европейского союза строгих ограничений по её использованию нет.
Существует неподтверждённая информация о том, что в процессе термообработки хлорид аммония становится токсичным и опасным для человека. Официальных доказательств пока обнародовано не было. Также нет у науки подтверждённых данных о возможной мутагенности или онкогенности вещества.
Хлорид аммония в виде порошка или раствора применяется во многих сферах промышленности
Для человека это вещество не представляет серьёзной опасности при соблюдении некоторых элементарных требований осторожности, оно легко всасывается и выводится из организма, не причиняя ему существенного вреда. Знаменитые лакричные конфеты, а также мучные изделия, макароны, сладости и плодовое вино – в этих продуктах можно столкнуться с пищевой добавкой Е510
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Будем признательны, если воспользуетесь кнопочками:
Описание
Его молекулярная масса составляет 53,49 г моль -1 .
Образуется по реакции: HCl + NH 3→ NH 4 Cl.
Это соединение опасно для здоровья:
- R22: вреден при проглатывании;
- R36: раздражает глаза;
- S22: не вдыхать пыль.
Хлорид аммония (пищевая добавка № Е 510) в чистом виде представляет собой белую кристаллическую соль , растворимую в воде. Водный раствор слабокислый.
При комнатной температуре, хлорид аммония кристаллизуется в кубической системе , с пространственной группой P м -3 м (CsCl типа структура). При 456 K он показывает структурный переход в пространственную группу F m -3 m (NaCl-подобная структура).
Его молярная масса составляет 53,49 г / моль, а плотность — 1,5274 г / см3 . Он разлагается при 338 ° C , а его растворимость в воде составляет 37,2 г на 100 г воды при 20 ° C .
Использует
Хлорид аммония или часто лосось используется:
- в металлургии и химии металлов:
- пайки мягкий: в качестве компонента некоторых потоков , и в твердой форме под торговым названием каменного аммиака, чтобы лишить вниз по паяльникам ;
- различные сварные швы ;
- очистка черных и цветных металлов, таких как медь и цинк;
- лужение железных или медных сосудов в изделиях из латуни;
- что батареи Leclanché : электролит сухой батареи;
- исследование затвердевания: хлорид аммония в воде затвердевает как дендритный металлический сплав;
- за его поверхностные свойства, в частности, как средство для чистки металлов или его действие на другие специфические поверхности:
- обработка снега , особенно на склонах при температуре выше ° C, для укрепления снега и замедления его таяния ;
- в научной фотографии , в частности в фотографии горных пород или окаменелостей , с целью отбеливания поверхностей. Нанесенный на блестящую поверхность, он становится матовым, но при этом очень ненавязчиво подчеркивает мельчайшие детали;
- различные чистящие средства;
- в косметике, в шампунях ;
- для окрашивания из текстиля ;
- в клеях для фанеры ;
- в промышленности или приготовлении пищи:
- добавки в производстве солодки гранул в странах Северной Европы ( Salmiakki финский, Lakrisal (в) шведском, Dracula Piller (еп) Датский) Нидерланды (Heist падения) и Германия ;
- ароматизатор для водок;
- ингредиент питательной среды для дрожжей ;
- в медицине или ветеринарии:
- что препараты против кашля ; его отхаркивающее действие обусловлено тем , что он вызывает раздражение слизистых оболочек на бронхи ;
- в иммуногистохимии для разделения поликлональных антител и других белков кроветворной сыворотки путем преципитации;
- в тесте для диагностики почечного канальцевого ацидоза ;
- кормовые добавки для животных (по рецепту ветеринара).
Применение Е-510
Е-510 зарегистрирован как добавка-улучшитель муки и хлеба.
В небольшом количестве нашатырь помогает привести человека в чувство и вывести из предобморочного состояния, потому что пары этого вещества вызывают очень сильное возбуждение дыхательных центров. Но вдох большого количества нашатыря очень опасен, так как может вызвать остановку дыхания. Раньше хлорид аммония использовался для лечения бронхита, как отхаркивающее средство. Сейчас слобоконцентрированный раствор нашатыря применяется в медицине как мочегонное средство. Он легко всасывается из желудочно-кишечного тракта и так же легко выводится почками, забирая с собой лишнюю жидкость. В пищевой промышленности используется редко.
В Финляндии и некоторых скандинавских странах применяется как приправа к пище, и входит в состав лакричных конфет.
Реакции [ править ]
Хлорид аммония пиролизуется и превращается в дым хлорида аммония после охлаждения.
Хлорид аммония, кажется, возгоняется при нагревании, но фактически разлагается на аммиак и газообразный хлористый водород .
- NH 4 Cl → NH 3 + HCl
Хлорид аммония реагирует с сильным основанием, таким как гидроксид натрия , с выделением газообразного аммиака:
- NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Точно так же хлорид аммония также реагирует с карбонатами щелочных металлов при повышенных температурах, давая аммиак и хлорид щелочного металла:
- 2 NH 4 Cl + Na 2 CO 3 → 2 NaCl + CO 2 + H 2 O + 2 NH 3
5% -ный по весу раствор хлорида аммония в воде имеет pH в диапазоне от 4,6 до 6,0.
Некоторые реакции хлорида аммония с другими химическими веществами являются эндотермическими, например, его реакция с гидроксидом бария и его растворение в воде.
Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
- металлургия – травление металлов;
- деревообработка – защита древесины от вредителей;
- медицина – производство лекарств;
- пищепром – приправа;
- химическая промышленность – реагент для опытов;
- радиотехника – удаление оксидной пленки в процессе пайке;
- машиностроение – устранение загрязнений с поверхности;
- пиротехника – дымообразователь;
- гальваника – электролиты;
- сельскохозяйственные работы – азотное удобрение;
- фотодело – фиксаж для снимков.

В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
- При обмороке нашатырь оказывает возбуждающее действие на человека, приводит в сознание.
- При отеках ценится действие диуретиков или мочегонных веществ, выводящих лишнюю жидкость.
- При пневмонии, хроническом бронхите и бронхиальной астме помогает от сильного кашля.
На втором месте находится пищевая промышленность. Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин. В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц. Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла. Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.

Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях. Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов. Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
Физические свойства
Бесцветные или белые кристаллы кубической сингонии (а = 0,38758 нм, z = 1, пространственная группа Pm3m). Относительная плотность d420{\displaystyle d_{4}^{20}} = 1,526. Кубическая модификация стабильна ниже температуры 184,3 °C. Соединение возгоняется при 337,6 °C с разложением на аммиак и соляную кислоту.
Хорошо растворим в воде (37,2 г / 100 мл), жидком аммиаке. Водные растворы вследствие гидролиза имеют слабокислую реакцию. Температура кипения насыщенных водных растворов 116 °C.
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Примеры решения задач
Задача 1
Сколько хлорида аммония получается при производстве 1 т пищевой соды по аммиачному методу?
Решение
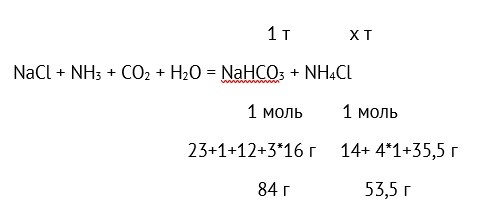
Составляем пропорцию:
84 г NaHCO3 – 53,5 г NH4Cl,
1 т NaHCO3 – х т NH4Cl
отсюда
х=1 * 53,5 / 84 = 0,637 т = 637 кг.
Ответ: 637 кг.
Задача 2
Сколько тепла выделится при сгорания 34 г аммиака в атмосфере хлора?
Решение
34 г
8NH3 + 3Cl2 = N2 + 6NH4Cl
8 моль
8 (1+16) г
136 г
Изменение энтальпии в ходе химической реакции:
ΔHхр=∑ΔHпрод−∑ΔHисх=ΔHN2(г)+6ΔHNH4Cl(к)−8ΔHNH3(г)−3ΔHCl2(г)==+6⋅(−314,2)−8⋅(−46,19)−3⋅=−1515,68 кДж\Delta H_{хр}^0 = \sum \Delta H_{прод}^0 -\sum \Delta H_{исх}^0 =\Delta H_{N2(г)}^0 + 6 \Delta H_{NH4Cl(к)}^0-8\Delta H_{NH3(г)}^0-3 \Delta H_{Cl2(г)}^0=
= 0 + 6·(-314,2) – 8·(-46,19) -3·0 = -1515,68\ кДжΔHхр=∑ΔHпрод−∑ΔHисх=ΔHN2(г)+6ΔHNH4Cl(к)−8ΔHNH3(г)−3ΔHCl2(г)==+6⋅(−314,2)−8⋅(−46,19)−3⋅=−1515,68кДж.
Составляем пропорцию:
136 г NH3 – 1515,68 кДж,
34 г NH3 – х кДж.
отсюда
х=34 * 1515,68 / 136 = 378,92 кДж.
Ответ: 378,92 кДж.















![Хлорид аммониясодержание а также производство [ править ]](http://parfum-asmodeus.ru/wp-content/uploads/6/8/a/68a1f7050e5b2479932da7b0ccf8d466.png)










