«Об Инструкции о порядке медицинского освидетельствования для установления факта употребления алкоголя и состояния опьянения в учреждениях Комитета здравоохранения г. Москвы» (Приказ Комитета здравоохранения Правительства Москвы № 340 от 26.06.97)
Приложение
к приказу Комитета здравоохранения
Правительства Москвы
от 26.06.97 № 340
Критерии определения состояний алкогольного опьянения и одурманивания
Заключение «Установлен факт употребления алкоголя», признаков опьянения не выявлено» выносится при наличии убедительных данных, подтверждающих факт употребления алкоголя, но при отсутствии четкой клинической картины алкогольного опьянения. Для данного состояния характерны — гиперемия склер, нарушение координационных проб, слабый запах алкоголя или запах перегара изо рта.
В этих случаях проба с индикаторной трубкой Мохова-Шинкаренко (контроль трезвости) и реакция Раппопорта будут слабо положительными, а содержание алкоголя в биологических средах колеблется с 0,022‰ до 1‰.
При легкой степени алкогольного опьянения изменения психической деятельности незначительны. Отмечается усиление вегетативно-сосудистых реакций — гиперемия кожи, инъекция склер, повышенная потливость, тахикардия, повышение АД, учащенное дыхание, а также нистагм, расширение зрачков; нарушение двигательной сферы — изменение походки, пошатывание при ходьбе с быстрыми поворотами, неустойчивость в простой и сенсибилизированной позе Ромберга, неточность выполнения точных движений и координаторных проб.
При легкой степени алкогольного опьянения содержание алкоголя в биологических средах колеблется от 1 до 2‰.
При средней степени алкогольного опьянения отмечаются более выраженные изменения психической деятельности — неправильная оценка ситуации, заторможенность или возбуждение, агрессия, дизартрия, слюнотечение.
Вегето-сосудистые расстройства проявляются в виде гиперемии или побледнения кожных покровов и слизистых, учащения пульса, дыхания, колебания АД, потливости. Наблюдается расширение зрачков, вялая фотореакция, нистагм, шаткость походки, неустойчивость в позе Ромберга, отчетливые нарушения координаторных проб, снижение сухожильных рефлексов, болевой чувствительности. Содержание алкоголя в биологических средах в этих случаях колеблется от 2 до 3‰.
При тяжелой степени алкогольного опьянения отмечается нарушение ориентировки, заторможенность, сонливость, малая доступность контакту, непонимание смысла вопросов, тахикардия, артериальная гипотония, бледность кожи и слизистых, слабая реакция зрачков на свет, нистагм, резкое нарушение походки, неспособность самостоятельно стоять и выполнять целенаправленные действия, подавление сухожильных рефлексов, снижение корнеальных рефлексов. Зрачки расширены, но при переходе в алкогольную кому зрачки могут быть сужены. Содержание алкоголя в биологических средах в этих случаях колеблется от 3 до 4‰.
При алкогольной коме отмечается нарушение сознания, отсутствие реакций на окружающее, тяжелые нарушения вегетативной регуляции, сердечно-сосудистой деятельности, резкое снижение мышечного тонуса, отсутствие болевых, роговичных, сухожильных рефлексов, патологические рефлексы, гиперкинезы. Возможны непроизвольное мочеиспускание, дефекация, расстройства дыхания, зрачки расширены, реакция их на свет отсутствует. Содержание алкоголя в биологических средах при коме свыше 4‰.
Состояние одурманивания, вызванное наркотическими или другими веществами. Такое заключение выносится при наличии клинических симптомов опьянения, вызванного употреблением наркотических или сильнодействующих веществ, отсутствии запаха алкоголя изо рта и отрицательных химических пробах на алкоголь.
В подобных случаях для подтверждения состояния одурманивания, кроме клинического описания симптомов опьянения, необходимы результаты химических исследований биологических жидкостей.
| от 1 до 2 ‰ | легкая степень опьянения |
| от 2 до 3 ‰ | средняя степень опьянения |
| от 3 до 4 ‰ | тяжелая степень опьянения |
| свыше 4 ‰ | алкогольная кома |
Приказ Комитета здравоохранения Правительства Москвы от 26.06.97 № 340 «Об Инструкции о порядке медицинского освидетельствования для установления факта употребления алкоголя и состояния опьянения в учреждениях Комитета здравоохранения г. Москвы»
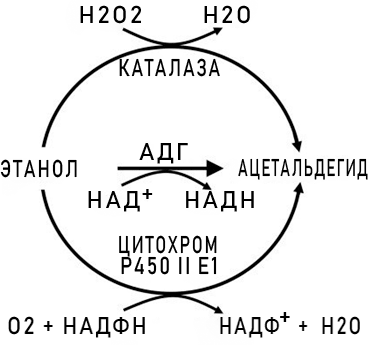
[править] Воздействие этилового спирта на человека
Мозг и алкоголь — Вячеслав Дубынин // ПостНаука
Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм.
ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³.
Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения).
[править] Получение
Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена):
Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле:
C6H12O6 → 2C2H5OH + 2CO2 + 27 ккал
Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто.
В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH
Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа:
CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Реакция осложняется образованием диэтилового эфира.
Химический состав, свойства, области применения глицерина и жирных кислот
Глицерин
Глицерин (>греч. glikeros – сладкий) – простейший трехатомный спирт СН2ОНСНОНСН2ОН. Это бесцветная, вязкая жидкость сладкого вкуса без запаха. Смешивается в любых соотношениях с водой. Поглощает влагу из воздуха (до 40 % от своей массы).
Благодаря наличию в молекуле трех реакционно способных гидроксильных групп может образовывать три ряда производных: моно-, ди- и три-. Глицерин впервые был получен в 1779 году шведским химиком Шееле при омылении оливкового масла в присутствии свинцового глета PbO. Однако промышленное производство глицерина начало развиваться только в середине 19 века.
Глицерин находит самое широкое применение в производстве пластических масс, лакокрасочных материалов, а также пищевых продуктов (производство моно- и диглицеридов), парфюмерно-косметических и фармацевтических препаратов. Глицерин используется также в текстильной, целлюлознобумажной, резинотехнической и других отраслях промышленности.
Жирные кислоты
Жирные кислоты, точнее высшие жирные кислоты (ВЖК) – это натуральные (природные) и синтетические карбоновые кислоты алифатического ряда с числом атомов углерода в молекуле не менее 6. В нашем случае интерес представляют натуральные ВЖК, или просто – жирные кислоты (ЖК).
Натуральные жирные кислоты представляют собой одноосновные кислоты нормального строения с четным числом атомов углерода в молекуле; могут быть как насыщенными, так и ненасыщенными. Кроме карбоксильной группы —СООН, они могут содержать другие функциональные группы, например, гидроксильную группу — ОН (рицинолевая оксикислота). В животных жирах и растительных маслах наиболее распространены кислоты с 10…22 атомами углерода в молекуле.
Жирные кислоты применяются для получения мыла, высших жирных спиртов, в производстве алкидных смол, сиккативов, алифатических аминов, в производстве пластификаторов, замасливателей для тканей и др. Как правило, в промышленности используют смеси жирных кислот. Для технических нужд выпускаются олеиновая, стеариновая и рицинолевая кислоты. Производство других индивидуальных жирных кислот, например, линолевой и линоленовой кислот и их метиловых и этиловых эфиров, не имеет большого распространения.
Следует заметить, что ресурсы производства натуральных жирных кислот, причем ресурсы возобновляемые, значительны. Однако фракционный состав их узок и ограничивается кислотами состава С12…С18, а главным образом – С16 и С18. Возросший интерес различных отраслей промышленности к кислотам, содержащим менее 12-ти и более 20-ти атомов углерода, стимулирует развитие производства жирных кислот из нефтехимического сырья, на долю которых в настоящее время приходится только около 10 %.
[править] Ссылки
| (0°) | Метанол |
|---|---|
| Первичные спирты (1°) |
Этанол · Пропанол · н-Бутанол · Изобутанол · Амиловый спирт · Гексанол · Гептанол
Жирные спирты: Октанол (C8) · Нонанол (C9) · Деканол (C10) · Ундеканол (C11) · Додеканол (C12) · Тетрадеканол (C14) · Цетиловый спирт (C16) |
| Вторичные спирты (2°) | Изопропиловый спирт · втор-Бутанол · Гексан-2-ол |
| Третичные спирты (3°) | трет-Бутанол · 2-Метилбутан-2-ол |
| Высокоалкогольные (66−96 %) | Абсент • Спирт • Первач • Штро |
|---|---|
| Крепкие (31−65 %) | Авамори • Аквавит • Арак • Арманьяк • Бальзам • Биттер • Боровичка • Бренди • Бумбо • Буха • Виски (бурбон, скотч) • Водка (Ароматизированная, «Байкал», «Гетман», «Журавли», Путинка, Russian Shot, НМПТ Русская водка) • Граппа • Джин • Дивин • Ерофеич • Женевер • Зубровка • Кальвадос • Кашаса • Киршвассер • Клековача • Коньяк • Крамбамбуля • Крупник • Ламбиг • Ликёр • Маотай • Мескаль • Мараскин • Метакса • Настойка (горькая) • Орухо • Палинка • Писко • Потин • Ракия • Ракы • Ратафия • Ром • Самбука • Самогон • Сетю • Сливовица • Старка • Текила • Тутовка • Узо • Фернет • Чача • Шнапс • Яловийна • The Botanist |
| Среднеалкогольные (9−30 %) | Вермут • Вино • Глинтвейн • Глёг • Грог • Кампари • Крюшон • Ликёр • Малага • Мёд • Мистель • Наливка • Пачаран • Поммо • Портвейн • Пунш • Рецина • Саке • Сангрия • Сётю • Соджу • Туак • Херес • Шампанское (севастопольское) |
| Слабоалкогольные (1,5−8 %) | Алкопоп • Березовица • Боза • Буза • Брага • Душепарка • Квас • Кумыс • Медовуха • Перри • Пиво (Старый мельник, Free Beer, White House Honey Ale) • Пульке • Сбитень • Сидр • Тесгуино • Тодди • Чайный гриб • Чича • Эль |
| Употребление и последствия | Алкоголизм (алкаш, у лесбиянок, у мужчин) • Алкогольный синдром плода • Воздействие на человека • Зависимость числа дебилов от потребления • Запой • Отравление • Употребление Ельциным • Уход в запой |
| Запреты | На ввоз грузинских вин в Россию • Вина из сортов Изабелла и Лидия из-за метанола |
| Лексика | Алаверды • Горько! • Заложить за воротник • Известная русская «слабость» • Напиться как свинья • Прохоров • Для проверки степени опьянения • Тост |
| Разное | Алкотуризм • Бирпак • Выдержка • Вытрезвитель • Зелёный мексиканец • Крепость • Содержание в кефире • Спор за бренд Водка • Текильщица • Фабрикация исследований о пользе красного вина • Щипцы для портвейна |
|
Основные виды органического топлива |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Ископаемое |
|
||||||||
| Возобновляемое и биологическое |
Валежник • Дрова • Кизяк • Навоз • Древесный уголь • Этанол • Биодизель • Биоэтанол • Бутанол-1 • Метанол • Свалочный газ • Болотный газ • Биогаз • Биоводород | ||||||||
| Искусственное | Доменный газ • Светильный газ • Коксовый газ • Трет-бутилметиловый эфир • Синтез-газ • Синтетическое топливо • Генераторный газ • Водород • Водоугольное топливо • Пековый кокс | ||||||||
| Разное | Газификация угля |
Допустимое суточное потребление
Очень желательно вообще не употреблять продукты, в составе которых есть антибиотики, в том числе и пимафуцин. В крайнем случае разрешено употреблять не более 0,3 мг на один килограмм веса взрослого человека. А детям, беременным и кормящим женщинам антибиотики и вовсе противопоказаны.
Как определить добавку в продукте?
Согласно российскому законодательству, производитель продуктов питания должен указывать в составе товара на упаковке все добавки, в том числе и эту. Маркером е235 могут служить также такие наименования:
- Натамицин;
- Пимарицин;
- Natamycin;
- Pimaricin.
Чем можно заменить?
В медицине существует множество аналогов пимафуцина. Что же касается пищевой промышленности, то здесь добавку е235 заменяют обычно «Натамаксом» или «Дельвоцидом», в которых активным веществом является все тот же пимафуцин.
В каких странах запрещена, а в каких разрешена
Добавка е2335 разрешена к использованию в пищевой промышленности в России и странах СНГ, однако в США и в ряде других стран она категорически запрещена.
Свойства
Внешний вид: в обычных условиях представляет собой бесцветную летучую жидкость с характерным запахом.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | смешивается с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | 1,3611
(температурный коэффициент показателя преломления 4,0·10−4, |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
| Температура, °C | 10 | 20 | 30 | 40 | 50 | 60 | |
| ρ, г/см³ | 0,8062 | 0,7979 | 0,7893 | 0,7810 | 0,7722 | 0,7632 | 0,7541 |
| Массовое содержание C2H5OH, % | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| ρ, г/см³ | 0,99636 | 0,99453 | 0,99103 | 0,98780 | 0,98478 | 0,98187 | 0,97910 | 0,97643 | 0,97387 |
| Массовое содержание C2H5OH, % | 18 | 20 | 22 | 24 | 26 | 28 | 30 | 35 | 40 |
| ρ, г/см³ | 0,97129 | 0,96864 | 0,96592 | 0,96312 | 0,96020 | 0,95710 | 0,95382 | 0,94494 | 0,93518 |
| Массовое содержание C2H5OH, % | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| nD20 | 1,3396 | 1,3470 | 1,3535 | 1,3580 | 1,3612 | 1,3633 | 1,3646 | 1,3649 | 1,3642 | 1,3613 |
| Температура, °C | 10 | 20 | 30 | 40 | 50 | 60 | |
| σ, Н/м | 2,405·10−2 | 2,314·10−2 | 2,203·10−2 | 2,148·10−2 | 2,020·10−2 | 1,980·10−2 | 1,843·10−2 |
| Давление, кПа (мм. рт. ст.) | 0,133(1) | 0,667(5) | 1,333(10) | 2,666(20) | 5,333(40) |
| Tкип, °C | −31,3 | −12,0 | −2,3 | 8,0 | 19,0 |
| Давление, кПа (мм. рт. ст.) | 7,999(60) | 13,333(100) | 26,66(200) | 53,33(400) | 101,32(760) |
| Tкип, °C | 26,0 | 34,9 | 48,4 | 63,5 | 78,4 |
Смесь 96 % спирта и 4 % воды (95.57 % этанола + 4.43 % воды) является азеотропной — т. е. не разделяется при перегонке.
«О судебно-медицинской диагностике смертельных отравлений этиловым алкоголем и допускаемых при этом ошибках» (Методические указания Минздрава СССР от 03.07.1974)
Для практической экспертной работы, в соответствии с критериями, предложенными В.И. Прозоровским, И.С. Карандаевым и А.Ф. Рубцовым (1967)1, может быть рекомендована следующая ориентировочная схема для определения степени выраженности алкогольной интоксикации 2:
| от 0,3 до 0,5‰ | незначительное влияние алкоголя |
| от 0.5 до 1,5‰ | легкое опьянение |
| от 1,5 до 2,5‰ | опьянение средней степени |
| от 2,5 до 3,0‰ | сильное опьянение |
| от 3,0 до 5,0‰ | тяжелое отравление алкоголем, может наступить смерть |
| от 5,0 до 6,0‰ | смертельное отравление |
1Вопросы организации экспертизы алкогольного опьянения / Прозоровский В.И., Карандаев И.С., Рубцов А.Ф. // Судебно-медицинская экспертиза. — 1967. — №1. — С. 3-8.
2О судебно-медицинской диагностике смертельных отравлений этиловым алкоголем и допускаемых при этом ошибках : методические указания / В.И. Прозоровский. — М.: МЗ СССР, 1974.
Получение
Существует 2 основных способа получения этанола — микробиологический (брожение и гидролиз) и синтетический:
Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих сахар (свёкла и т. п.). Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, древесины и проч. под действием фермента зимазы. Реакция эта довольно сложна, её схему можно выразить уравнением:
C6H12O6 → 2C2H5OH + 2CO2
В результате брожения получается раствор, содержащий не более 15 % этанола, так как в более концентрированных растворах дрожжи обычно гибнут. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Спирто-водные растворы с концентрацией этанола 30-75 %, получаемые путём примитивной перегонки в домашних условиях, называются в России — самогон, на Украине — самогон, в Англии — виски, в Грузии — чача, в Японии — сётю.
Промышленное производство спирта из биологического сырья
- Винокуренные заводы
- Гидролизное производство
Для гидролизного производства применяется сырьё, содержащее целлюлозу — древесина, солома.
Отходами бродильного производства являются
барда и сивушные масла
Гидратация этилена
- В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:CH2=CH2 + H2O → C2H5OH
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа):CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Эта реакция осложняется образованием диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95.6 % об.; эта неразделимая перегонкой азеотропная смесь содержит 4.4 % воды (вес.) и имеет температуру кипения 78.2 °C.
Перегонка освобождает зтанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Кипение при температуре 78,39 °C в то время как спирт спирт-ректификат, содержащий не менее 4,43 % воды кипит при температуре 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами.
Применение
Химическая промышленность
- Служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- Широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- Является компонентом антифриза.
Медицина
Файл:Ethanol antiseptic.jpg
Этиловый спирт в первую очередь используется как антисептик
- как обеззараживающее и подсушивающее средств, наружно;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %)
- При инфаркте, в отсутствие других средств можно принять однократно 50-100 мл водки внутрь.
Парфюмерия и косметика
Является универсальным растворителем различных душистых веществ и основным компонентом духов, одеколонов и т. п. Входит в состав разнообразных лосьонов.
Пищевая промышленность
Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1−3 % этанола (в крепком до 4,5 %), в квасе — от 0,6 до 2,2 %.
Растворитель для пищевых ароматизаторов.
Применяется как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Судебно-медицинская диагностика острых смертельных отравлений алкоголем (РЦСМЭ, 2005)
* Судебно-медицинская диагностика острых смертельных отравлений алкоголем : Пособие для врачей судебно-медицинских экспертов / А.В. Капустин, О.А. Панфиленко, В.Г. Серебрякова. — M.: РЦСМЭ, 2005.
| в крови 0,3‰, в моче 0‰ | трезв, судить о факте употребления алкоголя нельзя |
| в крови 0,4-1,0‰ | в моче меньше, чем в крови — можно сделать вывод о факте употребления алкоголя. Могут быть отдельные признаки алкогольного опьянения, однако развернутого синдрома алкогольного опьянения обычно не наблюдается. Утверждать, что было состояние алкогольного опьянения достоверно нельзя |
| в крови от 1,0 до 2,0‰ | в моче меньше, чем в крови — легкая степень алкогольного опьянения |
| в крови от 1,0 — 2,0‰, в моче значительно больше, чем 2% | определение степени тяжести алкогольного опьянения производится после оценки содержания этанола в крови с учетом его концентрации в моче (средняя или тяжелая степень алкогольного опьянения) |
| в крови свыше 2,0‰ до 3,0‰ | в моче меньше, чем в крови — средняя степень алкогольного опьянения |
| в крови свыше 2,0‰до 3,0‰, в моче свыше 3,0‰ (до 4,0‰ и более) |
тяжелая степень алкогольного опьянения |
| в крови свыше 3,0‰, в моче менее 3,0‰ в стадии резорбции и более 3,0‰ в стадии элиминации (максимум концентрации не имеет значения) |
тяжелая степень алкогольного опьянения. Возможна алкогольная кома и наступление смерти |
* Приведенная схема имеет достаточно приблизительный характер, так как, помимо индивидуальной реакции на употребление алкоголя, о чем сказано
выше, само деление алкогольного опьянения по степени имеет достаточно условный характер, поскольку резкой границы между ними не существует. Поэтому при
обнаружении пограничных концентраций алкоголя в крови вывод о степени алкогольного опьянения при отсутствии клинических данных может быть только вероятным, так как в таких случаях возможна любая из двух смежных степеней опьянения.
Получение этилового спирта
Этиловый спирт получают брожением сахаристых веществ в присутствии дрожжей. Сущность брожения заключается в том, что получаемая из крахмала глюкоза, или виноградный сахар С6Н12О6, под действием ферментов распадается на спирт и оксид углерода (IV). Суммарный результат этого сложного многостадийного процесса выражается уравнением С6Н12О6 = 2С2Н5ОН+2СО2
Исходным материалом в производстве спирта служат природные продукты, богатые крахмалом: картофель, хлебные злаки и др. В настоящее время этиловый спирт получают не только из пищевых продуктов. Широко развито получение его из отходов древесины: она превращается в глюкозу, а последняя — в спирт.
Наиболее современный способ получения этилового спирта основан на реакции гидратации этилена, получаемого в больших количествах при крекинге нефти: СН2=СН2+Н2О—>СН3-СН2ОН
Реакция протекает при температурЕ-260-300°С, давлении 7,5-10 МПа и в присутствии кислотных катализаторов (фосфорная кислота на алюмосиликате с добавками солей кадмия, меди, кобальта), воды по прямой гидратации этилена в спирт имеются как а Рос так и за рубежом. В будущем будет осуществлен полный переход на производство спирта из непищевого сырья — древесины и га нефтепереработки.
Получение спиртов
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.

Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.

Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
СН3—СНО + Н2 → CH3—CH2—OH
CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.

Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.

Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
-
Первичные спирты получают из муравьиного альдегида.
-
Уксусный альдегид и другие альдегиды дают вторичные спирты.
-
Кетоны и сложные эфиры образуют третичные спирты.
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.

Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.