Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3O+, HSO3+, и 2HSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
-
- H2SO4 + SO3 → H2S2O7 Сульфит
-
- H2SO4 + 2SO3 → H2S3O10
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
-
- lg p = A − B + 2,126 ,
- T
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
-
- H2SO4 ⟷ H2O + SO3 − Q .
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
-
- d = 1,851 7 − 1,1 ⋅ 10−3 t + 2 ⋅ 10−6 t2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
-
- λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Применение серной кислоты в производстве
Серная кислота, области применение которой разнообразны, используется так же при производстве минеральных удобрений. Для более удобного сотрудничества, заводы,что занимаются производством серной кислоты и минеральных удобрений, в основном, расположены поблизости друг от друга. Этот момент создает непрерывное производство.
Применение серной кислоты в изготовлении красителей и синтетических волокон занимает второе место по распространенности после производства минеральных удобрений. Многие отрасли промышленности используют серную кислоту в некоторых процессах на производстве. Применение серной кислоты нашло спрос и в быту. Люди пользуются химическим веществом для обслуживания своих автомобилей. Приобрести серную кислоту возможно в магазинах, что имеют специализацию по продаже химических веществ, в том числе у нас по ссылке. Серная кислота транспортируется соответственно правилам перевозки подобного груза. Железнодорожный или автомобильный транспорт перевозит кислоту в соответствующих емкостях. В первом случае в качестве емкости выступает цистерна, во втором – бочка или контейнер.
Применение серной кислоты
Конечно, в концентрированном виде серная кислота в пищевой промышленности не используется. Применяется только её 10-процентный раствор. Главным образом, добавку E513 используют в качестве подкислителя дрожжевого сусла. Этот подкислитель необходим в процессе приготовления спирта из крахмалосодержащего сырья. Нельзя забывать и о том, что данное вещество является хорошим регулятором кислотности в безалкогольных напитках, а также катализатором инверсии сахаров (в данном случае применяется E513 крайне редко).
Эмульгатор E513 прекрасно подходит для обработки загрязнённых дрожжей. Кислота буквально выжигает посторонние микроорганизмы, не разрушая при этом дрожжевую структуру. Используется она при рафинации жиров.
Пищевая промышленность – это не единственная сфера, где она нашла своё широкое применение. В сельском хозяйстве без неё тоже трудно обойтись. Её активно используют в изготовлении минеральных удобрений: так, вещество является важным элементом в образовании минеральных кислот и солей. Используется она и в тяжёлой промышленности, где она является электролитом в свинцовых батареях.
Опыты с веществом вспомнит, пожалуй, каждый школьник, поэтому логично, что её используют и в химпроме. С её помощью осуществляется производство взрывчатки, химических волокон, красителей. Также добавка E513 необходима тем, кто работает в кожевенной, нефтяной, текстильной и металлообрабатывающей отраслях.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
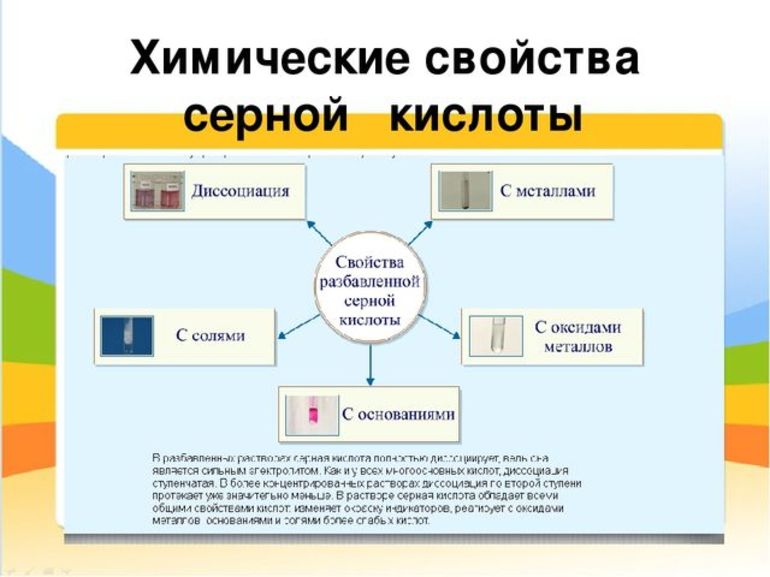
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
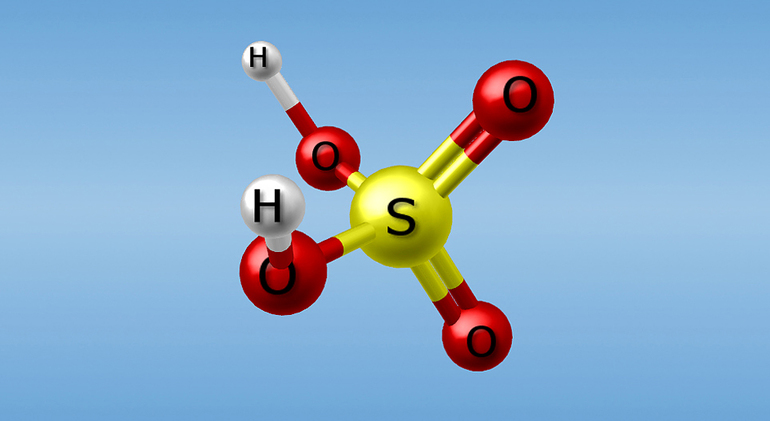
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
Основные производители добавки E513

Серная кислота относится к тем веществам, которые достаточно легко производить. На этом поприще работают немало отечественных и зарубежных предприятий. На территории Российской империи первое предприятие по производству серы было основано в 1805 году. Производственные мощности располагались в Звенигородском уезде, в Подмосковье. До начала Первой мировой войны Российская империя входила в топ-15 стран-производителей серной кислоты. Ныне же среди производителей стоит о (Среднеуральская область), «Кольскую металлургическую компанию» (Мурманск), открытое акционерное общество «Аммофос» из Вологодской области, а также мировых производителей вроде тунисского предприятия «Groupe Chimique Tunisien», «Туркменабатский химический завод имени Сапармурата Ниязова», китайскую и проч.
Классификация
H2SO4 выше 40% называется концентрированной. Она известна как сильный окислитель и при контакте с серебром или палладием растворяет их. Во время нагревания демонстрирует окислительно-восстановительные качества. Концентрация разбавленных растворов не превышает 40%. Они отличаются меньшей активностью и способны взаимодействовать с медью и латунью. Чтобы преобразовать концентрированную смесь в разбавленную, более тяжёлую жидкость нужно смешать с H2O
Важно добавлять именно кислоту в воду, соблюдая осторожность. Если сделать наоборот, образуется кипение и токсикологические брызги
Консервант Нитрат калия в сыре. Консервант Е252 (Нитрат калия)
Название: Е252, Нитрат калия Другие названия: Е252, Е-252, калиевая соль азотной кислоты, азотнокислый калий, калиевая селитра, калийная селитра. Анг: Potassium nitrate Группа: пищевая добавка Вид: консервант Влияние на организм: опасна как канцероген Разрешена в странах: некоторые из стран ЕС
Описание Е252 (Нитрат калия)
В настоящее время пищевую добавку Е252 или нитрат калия получают искусственным способом. В природе нитрат калия образуется на влажных почвах богатых азотистыми веществами. Катализатором образования нитрата калия служит тепло и вода. Именно в странах с жарким климатом (Чили, восточная Индия) находятся крупные месторождения этого вещества в виде минерала нитрокалита. Наши предки знали о свойствах нитрата калия и научились получать его из смеси навоза и известняка или древесной золы. Использовали его в качестве ценного удобрения. В настоящее время пищевую добавку Е252 получают с помощью хлорида калия и нитрата аммония. Также существует способ получения нитрата калия при реакции нитрата натрия с хлоридом калия. На внешний вид пищевая добавка Е252 представляет собой кристаллический бесцветный порошок, который не имеет ни цвета, ни запаха. В составе Е252 присутствуют хлориды и нитриты в качестве примесей. Он хорошо растворим в воде, в средней степени растворим в глицерине, и вообще не растворим в эфире и этаноле, немного гигроскопичен. По химическим свойства это вещество является сильным окислителем, находясь в смеси с некоторыми органическими веществами может воспламенять их. Химическая формула нитрата калия — КNO3. В пищевой промышленности пищевую добавку Е252 используют в качестве консерванта, так как она предотвращает развитие микробов и бактерий, продлевая таким образом сохранность продукта.
Применение Е252 (Нитрат калия)
В пищевой промышленности пищевую добавку Е252 применяют при производстве колбасных изделий и консервировании мяса. Нитрат калия замедляет процесс вспучивания при производстве сыров. А вот в больших дозах Е252 способна изменять еще и окраску пищевого продукта. В данном случае нитрит калия добавляют к анчоусам для придания им более насыщенного(привлекательного) цвета. Кроме пищевой промышленности нитрат калия широко применяют в других областях народного хозяйства. Данное вещество применяют при изготовлении ракетного топлива, при производстве стекла, в профилактических зубных пастах, в качестве удобрения и как компонент при изготовлении пороха.
Влияние Е252 (Нитрат калия) на организм человека
Пищевая добавка Е252 на организм человека оказывает негативное влияние. Это обусловлено тем, что нитрат калия нарушает в крови баланс кислорода в организме человека. Поэтому возникает опасность возникновения приступов удушья для астматиков. Под воздействием высоких температур (производство колбасных изделий и консервирование мяса) нитрат калия превращается в нитриты, которые являются канцерогенами и постепенно могут привести к образованию различного рода опухолевых заболеваний. При употреблении большого количества продуктов, содержащих пищевую добавку Е252 , может возникнуть нерегулярное сердцебиение, острые боли в животе, рвота, мышечная слабость, боли в почках. Детям в возрасте до шести лет категорически запрещено употреблять продукты питания, которые содержат пищевую добавку Е252 . При изготовлении детского питания нитрат калия не применяют. В последнее время во многих странах мира наметилась тенденция о вводе запрета на использование Е252 в пищевой промышленности.
Сферы применения
| Сфера | Описание |
| Сельское хозяйство | Моногидрат из серной кислоты используют, как основной компонент минеральных, азотных и фосфорных удобрений для сельскохозяйственных культур. |
| Металлургия | С помощью 25% раствора H2SO4 проверяют качество стальных изделий, производят очистку металла для дальнейшего покрытия медью, хромом или никелем. |
| Пищевая промышленность | Пищевая добавка Е513 имеет в составе серную кислоту. |
| Добывающая промышленность | Для выделения элементов (урана, циркония) из руд. |
| Медицина | Соединения с серной кислотой активно используют для изготовления лекарственных препаратов. Особенно популярен раствор магний сульфата, который вводят роженицам для облегчения процесса родов. |
| Нефтяная промышленность | Для очистки нефтепродуктов. |
| Строительство | Входит в состав скрепляющих и отделочных материалов. |
| Производство | Из вещества производят красители, пластмассу, аккумуляторы, текстиль, моющие и взрывчатые вещества. |
| Применение в быту | Серная кислота активно используется для очищения металла от ржавчины и популярна среди автомобилистов. |
Правила работы с серной кислотой (профилактика)
Работа с серной кислотой требует особых мер предосторожности:
- защита дыхательных органов противогазом;
- защитная одежда с повышенной степенью защиты (кислостойкие сапоги, очки и маска из оргстекла);
- непосредственная близость к водопроводу, дабы промыть рану в случае травмирования;
- пролитое вещество необходимо нейтрализовать и тщательно смыть водой;
Важно запомнить, что в случае разбавления H2SO4 водой, именно кислота тонкой струйкой добавляется в воду. Если сделать наоборот, произойдёт реакция, логичным и неприятным исходом которой станет взрыв с выбросом концентрированных капель химиката
Правила работы с серной кислотой (профилактика)
Работа с серной кислотой требует особых мер предосторожности:
- защита дыхательных органов противогазом;
- защитная одежда с повышенной степенью защиты (кислостойкие сапоги, очки и маска из оргстекла);
- непосредственная близость к водопроводу, дабы промыть рану в случае травмирования;
- пролитое вещество необходимо нейтрализовать и тщательно смыть водой;
Важно запомнить, что в случае разбавления H2SO4 водой, именно кислота тонкой струйкой добавляется в воду. Если сделать наоборот, произойдёт реакция, логичным и неприятным исходом которой станет взрыв с выбросом концентрированных капель химиката
Нейтральные добавки
Нейтральных пищевых добавок Е с расшифровкой в таблице разрешенных и вредных веществ разрешенных веществ много.
|
Код добавки |
Название |
|
Е140 |
Краситель хлорофил |
|
Е202 |
Кислота сорбиновая |
|
Е260 |
Кислота уксусная |
|
Е330 |
Кислота лимонная |
|
Е410, Е415, Е412 |
Камедь |
|
Е471 |
Диглицериды и моноглицериды жирных кислот |
|
Е500 |
Сода пищевая |
|
Е917, Е916 |
Йодиды калия и кальция |
|
Е950 |
Калия ацесульфам |
|
Е951 |
Аспартам |
|
Е952 |
Натрия цикламат |
|
Е954 |
Сахарин |
|
Е957 |
Тауматин |
|
Е965 |
Мальтит |
|
Е967 |
Ксилит |
|
Е968 |
Эритрит |
Действие этих вещество заключается в следующем:
- Е140 – хлорофил (краситель). Способствует окрашиванию продуктов в цвет зелени. Элемент не вредит здоровью, по мнению некоторых специалистов полезен (способствует выведению токсинов, заживлению ран и устранению неприятных запахов от тела)
- Е202 – кислота сорбиновая. Вещество подавляет рост в продуктах плесени благодаря мощному антимикробному действию. Используется в сырах, колбасах, копченостях и ржаном хлебе. Является безопасным для здоровья.
- Е260 – кислота уксусная. Эта Е добавка из таблицы – самый распространенный кислотный регулятор. Маленькая дозировка приносит пользу, расщепляя углеводы и жиры. Увеличение концентрации свыше 30 % оказывает негативное влияние Е добавки из полной таблицы, вызывая кожные и слизистые ожоги. Элемент присутствует в соусах, майонезе, консервированных овощах, мясе и рыбе, изделиях кондитерского типа.
- Е330 – кислота лимонная. Она усиливает вкус продуктов и готовых блюд, регулирует кислотность и является консервантом. Как и другие виды кислот, в небольших дозах вреда не наносит. В концентрированном виде может вызвать ожог полости рта, желудка, пищевода, а также раздражение покровов кожи и путей дыхания.
- Е410, 415, 412 – камедь. Присутствует в десертах, мороженом, плавленых сырах, фруктовых и овощных консервах, паштетах, соусах, мучных изделиях как натуральная добавка. Вещество известно своими желеподобными свойствами и препятствованию кристаллизации продуктов. Элемент безопасен для организма, при этом имеет полезное свойство – уменьшение аппетита.
- Е471 – ди- и моноглицериды кислот (жирных). Вещества являются стабилизаторами и эмульгаторами натурального типа. Они присутствуют в паштете, майонезе, йогуртах. Чрезмерное употребление ведет к увеличению массы тела.
- Е500 – сода пищевая. Используется в качестве разрыхлителя хлебобулочных и кондитерских продуктов, препятствуя образованию комков и слеживанию готовых продуктов. Здоровью человека не вредит.
- Е917, Е916 — йодиды калия и кальция. Добавки, находящиеся в группе до конца не изученных. Гипотетически стимулируют работы железы (щитовидной), защищают от излучения радиации. Прием большого количества вызывает отравление.
- Е951 – аспартам, Е950 – калия ацесульфам, Е952 — натрия цикламат, Е957 — тауматин, Е954 — сахарин, Е967 — ксилит, Е965 — мальтит, Е968 — эритрит (сахарозаменители и подсластители). Содержатся в газированных напитках, десертах, леденцах, жевательных резинках и некоторых низкокалорийных продуктах.
Расшифровка Е-добавок из таблицы (вредных и полезных) остается предметом споров. Несмотря на выделение группы нейтральных веществ, некоторые все равно считают их опасными. Но, как и любые вещества, даже нейтральные элементы при злоупотреблении могут вызвать негативные последствия.
Сферы применения
| Сфера | Описание |
| Сельское хозяйство | Моногидрат из серной кислоты используют, как основной компонент минеральных, азотных и фосфорных удобрений для сельскохозяйственных культур. |
| Металлургия | С помощью 25% раствора H2SO4 проверяют качество стальных изделий, производят очистку металла для дальнейшего покрытия медью, хромом или никелем. |
| Пищевая промышленность | Пищевая добавка Е513 имеет в составе серную кислоту. |
| Добывающая промышленность | Для выделения элементов (урана, циркония) из руд. |
| Медицина | Соединения с серной кислотой активно используют для изготовления лекарственных препаратов. Особенно популярен раствор магний сульфата, который вводят роженицам для облегчения процесса родов. |
| Нефтяная промышленность | Для очистки нефтепродуктов. |
| Строительство | Входит в состав скрепляющих и отделочных материалов. |
| Производство | Из вещества производят красители, пластмассу, аккумуляторы, текстиль, моющие и взрывчатые вещества. |
| Применение в быту | Серная кислота активно используется для очищения металла от ржавчины и популярна среди автомобилистов. |
Запрещенные добавки
К запрещенным, но часто используемым, относятся следующие вещества:
- Е102 – тартразин желтый. Он применяется для окрашивания мороженого, сладостей, газированных напитков и йогуртов. Элемент может вызвать серьезные реакции аллергического типа, мигрень или нервное перевозбуждение. В большинстве мировых стран запрещен к использованию и крайне опасен для здоровья детей.
- Е121 – красный цитрусовый краситель. Это вещество добавляется в леденцы, напитки газированные и леденцы. Обладает сильными канцерогенными свойствами. В большинстве мировых стран запрещен к использованию.
- Е123 — амарант (краситель темно – красного цвета). Он используется в любимых всеми детьми желе, десертах, пудингах, мороженом, сухих завтраках, кексах и прочее. Эта химическая пищевая добавка поражает почки и печень, провоцирует развитие тяжелых реакций аллергического типа, насморк (хронический) и заболевания в сфере онкологии.
- Е240 – формальдегид. Это вещество является консервантом, который присутствует в приготавливаемых колбасных и мясных изделиях, различных напитках, десертов, желе, леденцов, жевательных резинок и тому подобных продуктов. Обладает сильными канцерогенными свойствами, порождая аллергические реакции, нарушения в работе нервной системы и интоксикацию в организме.
- Е924b, Е924a – броматы кальция и калия. Эти вещества способствуют улучшению качества продукции и окислению продуктов при производстве изделий хлебобулочного типа, а также используются как пеногасители для напитков, которые являются газированными. Эти вещества обладают сильными канцерогенными свойствами. В большинстве мировых стран эти добавки запрещено использовать по распоряжению Министерства здравоохранения.
Таблицы вредных и полезных Е-добавок содержат большое количество элементов, многие из которых не приносят человеческому организму ни пользы, ни вреда, оказывая влияние только на характеристики пищевого продукта. При этом чрезмерное употребление любого, даже самого полезного вещества из списка Е-добавок, может привести к возникновению проблем со здоровьем. Поэтому перед употреблением любых продуктов необходимо внимательно читать из чего они состоят
Если в него входят вещества из категории вредных Е-добавок, употреблять его следует либо с осторожностью, либо не есть вовсе
Применение ацетатов натрия
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E-262, и применяется как консервант.
Будучи солью слабой кислоты, в растворе ацетат натрия и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad) или химических обогревателей(англ. Hand warmer), применяется как составная часть смеси «горячего льда» (англ. «hot ice»), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс). При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду), он расплавляется и переходит в водный раствор ацетата натрия. При охлаждении этого раствора ацетата натрия, он образует перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить назад в твердую фазу тригидрата ацетата натрия. Этот процесс происходит при значительном выделении тепла (экзотермическая реакция), при этом процессе выделяется около 264—289 кДж/кг (Теплота фазового перехода).
Область применения технического ацетата натрия:
Технический натрий уксуснокислый (Ацетат натрия технический ) представляет собой тригидрат натриевой соли уксусной кислоты, выпускается в виде чешуек или кусков неправильной формы.
Натрий уксуснокислый применяется как противоморозная добавка для тяжёлого, мелкозернистого и легкого бетонов, при возведении монолитных бетонных и железобетонных конструкций, монолитных частей сборно-монолитных конструкций, замоноличивания стыков, при изготовлении сборных бетонных и железобетонных изделий и конструкций в неотапливаемых зданиях и на полигонах, а также при возведении конструкций из каменной кладки в зимних условиях при температуре наружного воздуха от плюс 5 до минус 15 градусов Цельсия.
Изучение серной кислоты
Первые письменные упоминания о необычном веществе были в трудах арабских алхимиков Хайяна и Джабира. Они отметили, что некоторые кислые газы можно невозбранно получать, если прокаливать железный купорос или квасцы. Впоследствии около IX века опыт с прокаливанием проводил алхимик Ар-Рази. Он прокаливал смесь медного и железного купоросов, получив на выходе слабый раствор серной кислоты. После крестовых походов знания Ар-Рази попали в Европу. Уже в XIII веке алхимик Альберт Магнус сумел усовершенствовать этот способ получения кислоты, которая спустя несколько веков стала пищевой добавкой E513.
Параллельно с Магнусом свои труды проводил и алхимик Валентин. Он заметил, что при сжигании смешанных в порошкообразном виде селитры и серы образуется газ, серный ангидрид. Если его поглощает вода, то образуется серная кислота. Этот способ производства был популярен в Советском Союзом до 1955 года. Тогда для изготовления использовались камеры, облицованные свинцом (этот металл в серной кислоте не растворяется).
Спустя два столетия после Валентина и Альберта Магнуса алхимикам удалось добыть серную кислоты из серного колчедана. Этот материал был более распространённым, чем сера, что на 300 лет вперёд закрепило способ производства серы из пирита как основной. В наше время вещество также может производиться окислением оксида серы и его растворением в 70-процентном растворе уже готовой кислоты. Побочным продуктом реакции является олеум.




























