Влияние Е1142 на здоровье человека — вред и польза
Несмотря на то, что в большинстве стран пищевая добавка Е 1142 разрешена к применению, существует целый ряд побочных эффектов на организм человека. Некоторые из них имеют очень серьезные последствия.
Начнем с того, что ацетилированный дикрахмалодипат очень плохо и тяжело усваивается в кишечнике, потому что процесс его переработки достаточно трудоемок и требует затраты большого количества энергии. Это влечет за собой повышенное газообразование, чувство распирания и тяжести в эпигастральной области, тошноту, боли в животе.
К более серьезным последствиям можно отнести полное прекращение двигательной активности желудка, что ведет к нарушению функционирования этого органа. Это в свою очередь может спровоцировать интоксикацию организма средней и тяжелой степени тяжести.
Самым грозным последствием отрицательного влияния Е1142 на пищеварительную систему и организм в целом считается панкреонекроз, потому как при переваривании ацетилированного дикрахмалодипата большая нагрузка ложится на поджелудочную железу.
О вредном влиянии этого вещества на организм сильно не афишируют. Но оно разрешено к применению, причем нет четкой предельно допустимой концентрации его в продуктах. А производители не любят и не указывают на упаковках точный состав и тем более концентрацию продуктов. И это наиболее распространенный химикат, используемый практически во всех продуктах детского питания.
Что же делать? Как избежать вредного воздействия Е 1142 на организм?
Полностью исключить из рациона продукты, содержащие ацетилированный дикрахмалодипат, на сегодняшний день почти невозможно. Но зато можно ограничить их употребление, особенно детьми. И самое главное — врага нужно знать в лицо. Обязательно стоит изучить всю известную информацию о данном веществе, в каких категориях продуктов оно чаще используется и возможна ли нейтрализация его воздействия на организм.
Опасна ли добавка Е516
E516 разрешена во всех странах. Потребители не могут узнать, сколько можно употреблять пищевой добавки без негативных последствий для организма. Такие данные отсутствуют.
Эмульгатор быстро усваивается и безопасен для человека. Польза его объясняется тем, что он является источником кальция. В составе продуктов питания концентрация сернокислого кальция невелика и не представляет опасности для человека.
Клинические исследования обнаружили, что сульфат кальция не оказывает вредного влияния на организм. Он не опасен даже при употреблении в больших количествах, так как быстро усваивается и выводится почками. Поэтому такая добавка не вредна и нигде не запрещена.
Доказано, что Е516 не влияет на организм людей, страдающих аллергическими реакциями. Не было обнаружено никакого вредного воздействия сернокислого кальция на организм даже самых чувствительных людей.

Слухи о вредности эмульгатора Е516 преувеличены. Рассматриваемая пищевая добавка не представляет опасности для человека и применяется в производстве большого количества пищевых продуктов. И если на этикетке встречается код Е516, это значит, что он неопасен для человека.
Посмотрите интересное видео про гипс:
Сульфат кальция — это… Что такое Сульфат кальция?
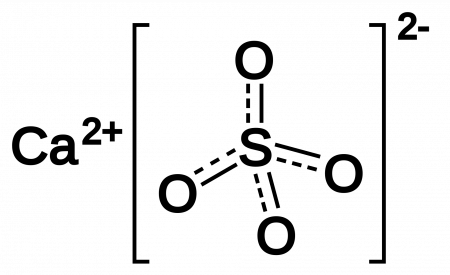
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4 ∙ 2h3O (гипс, селенит) и в безводном состоянии — ангидрит.
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5h3О и CaSO4 · 2h3О. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
В индустриальных масштабах добывают в составе природных минералов, например гипса, селенита или алебастра или получают синтетическим путём — сплавлением CaCl2 с K2SO4.
В аналитической химии может быть получен воздействием серной кислоты на оксид, карбонат, оксалат или ацетат кальция.
Образуется в результате окисления сульфида кальция при нагреве до 700—800 °C по реакции CaS + 2O2 = CaSO4.
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5h3O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO4 · 2h3О = CaSO4 · 0,5h3О + 1,5h3О. Значительные объёмы полученного таким путём алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.» .
Регистрационный номер CAS:
- ангидрат 7778-18-9 ;
- полугидрат 10034-76-1 ;
- двугидрат 10101-41-4 .
Применение
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Сульфит кальция
| Сульфит кальция | |
|---|---|
| Общие | |
| Систематическоенаименование | Сульфит кальция |
| Физические свойства | |
| Термические свойства | |
| Т. плав. | 600 °C |
| Химические свойства | |
| Классификация | |
Сульфит ка́льция (CaSO3) — неорганическое соединение,соль, не растворяется в воде, образует.
Получение
Сульфит кальция получают взаимодействием растворимых солей кальция с сульфитом натрия или калия:
-
- Ca(NO3)2+Na2SO3 → CaSO3↓+2NaNO3{\displaystyle {\mathsf {Ca(NO_{3})_{2}+Na_{2}SO_{3}\ {\xrightarrow {}}\ CaSO_{3}\downarrow +2NaNO_{3}}}}
- CaCl2+K2SO3 → CaSO3↓+2KCl{\displaystyle {\mathsf {CaCl_{2}+K_{2}SO_{3}\ {\xrightarrow {}}\ CaSO_{3}\downarrow +2KCl}}}
Физические свойства
Сульфит кальция образует бесцветные кристаллы, не растворимые в воде.
Образует кристаллогидрат состава CaSO3•2H2O, который при 100°С теряет воду.
Применение
Используется какE226 в качестве консерванта.
В пищевой промышленности используется как консервант, для приготовления желе, мармелада, мороженого, джема, повидла с низким содержанием сахара, сухофруктов, полуфабрикатов. Кроме того, консервант Е226 широко применяется в производстве вина, пива, фруктовых соков и других безалкогольных напитков. Используется при заморозке ракообразных и головоногих. Добавляется в тертый чеснок, хрен, картофель для предотвращения процесса потемнения. Добавка Е226 может использоваться для уплотнения растительных тканей в производстве консервов из овощей и фруктов.
Кальция Сульфат, что это такое. Применение
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку , плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии , травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы .».
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite , состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Так же находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1~2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
внешняя ссылка
Соединения, содержащие сульфат группа (ТАК2−4)
| ЧАС2ТАК4 | Он | ||||||||||||||||
| Ли2ТАК4 | BeSO4 | B | сложные эфирыРОСО3−(РО)2ТАК2 | (NH4)2ТАК4[N2ЧАС5] HSO4(NH3ОЙ)2ТАК4NOHSO4 | HOSO4 | F | Ne | ||||||||||
| Na2ТАК4NaHSO4 | MgSO4 | Al2(ТАК4)3Al2ТАК4(OAc)4 | Si | п | ТАК42−HSO3HSO4(HSO4)2 | Cl | Ar | ||||||||||
| K2ТАК4ХСО4 | CaSO4 | Sc2(ТАК4)3 | TiOSO4 | VSO4V2(ТАК4)3ВОСО4 | CrSO4Cr2(ТАК4)3 | MnSO4 | FeSO4Fe2(ТАК4)3 | CoSO4Co2(ТАК4)3 | NiSO4Ni2(ТАК4)3 | CuSO4Cu2ТАК4[Cu (NH3)4(ЧАС2O)] ТАК4 | ZnSO4 | Ga2(ТАК4)3 | Ge | В качестве | Se | Br | Kr |
| RbHSO4Руб.2ТАК4 | SrSO4 | Y2(ТАК4)3 | Zr (SO4)2 | Nb | MoSO4Пн2(ТАК4)3Пн (SO4)2Пн (SO4)2Пн (SO4)3 | Tc | Ru (SO4)2 | RhSO4Rh2(ТАК4)3 | PdSO4 | Ag2ТАК4AgSO4 | CdSO4 | В2(ТАК4)3 | SnSO4Sn (SO4)2 | Sb2(ТАК4)3 | Te | я | Xe |
| CS2ТАК4CsHSO4 | BaSO4 | Hf | Та | W | Re | ОсСО4Операционные системы2(ТАК4)3Ос (SO4)2 | ИрСО4Ir2(ТАК4)3 | PtSO4Pt (SO4)2 | AuSO4Au2(ТАК4)3 | Hg2ТАК4HgSO4 | Tl2ТАК4Tl2(ТАК4)3 | PbSO4Pb (SO4)2 | Би2(ТАК4)3 | PoSO4По (SO4)2 | В | Rn | |
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла2(ТАК4)3 | Ce2(ТАК4)3Ce (SO4)2 | Pr2(ТАК4)3 | Nd2(ТАК4)3 | Вечера2(ТАК4)3 | См2(ТАК4)3 | Европа2(ТАК4)3 | Б-г2(ТАК4)3 | Tb2(ТАК4)3 | Dy2(ТАК4)3 | Хо2(ТАК4)3 | Э2(ТАК4)3 | Тм2(ТАК4)3 | Yb2(ТАК4)3 | Лу2(ТАК4)3 | |||
| Ac2(ТАК4)3 | Чт (SO4)2 | Па | U2(ТАК4)3U (SO4)2UO2ТАК4 | Np (SO4)2 | Pu (SO4)2 | Являюсь2(ТАК4)3 | См2(ТАК4)3 | Bk | Cf | Es | FM | Мкр | Нет | Lr |
Применение
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.»
Сульфат кальция

| Сульфат кальция | |
|---|---|
 |
|
| Систематическоенаименование | Сульфат кальция |
| Традиционные названия | кальций сернокислый, «ангидрит» |
| Хим. формула | CaSO4 |
| Состояние | кристаллическое |
| Молярная масса | 136,1406 г/моль |
| Плотность | 2,96 г/см³ |
| Температура | |
| • плавления | 1450°C (с частичным разложением) |
| • разложения | 1560°C |
| Мол. теплоёмк. | 99.660 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1434,5 кДж/моль |
| Удельная теплота плавления | 28 кДж/моль |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,2036 г/100 мл воды |
| ГОСТ | ГОСТ 3210-77 ГОСТ 31108-2203 |
| Рег. номер CAS | 7778-18-9 |
| PubChem | 24497 |
| Рег. номер EINECS | 231-900-3 |
| SMILES | |
| Кодекс Алиментариус | E516 |
| RTECS | WS6920000 |
| ChEBI | 31346 |
| ChemSpider | 22905 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфа́т ка́льция (CaSO4) — неорганическое соединение, кальциевая соль серной кислоты.
Находится в природе в виде дигидрата CaSO4•2H2O (гипс, селенит) и в безводном состоянии — ангидрит.
Что такое Е516
Название этого вещества – кальция сульфат. Относится к стабилизаторам и эмульгаторам. В большом количестве находится в естественных условиях. Для пищевых целей гипс получают методом реакции кальция хлорида и сульфата калия.
Главные показатели Е 516:
- цвет – белый;
- состоит из сернокислого кальция;
- при комнатной температуре находится в кристаллах;
- запаха – нет;
- хорошо растворяется в кислотах, глицерине, аммониевых солях;
- слабо растворяется в холодной воде, нерастворим в спирте;
- вкус – горький, соленый;
- впитывает влагу.
Расфасовывается в многослойные мешки из бумаги, мягкие контейнеры.

Применение
Значительные объёмы алебастра используются в строительстве (из него изготавливают сухую штукатурку, плиты и панели для перегородок, гипсовые камни, архитектурные детали и др.). Изделия из гипса характеризуются сравнительно небольшой плотностью, несгораемостью и относительно невысокой теплопроводностью. Свойство алебастра затвердевать при смешении с водой нашло применение и в медицине, и в искусстве. «Это свойство гипса широко используют в ортопедии, травматологии и хирургии для изготовления гипсовых повязок, обеспечивающих фиксацию отдельных частей тела. Отвердевание замешанного с водой гипса сопровождается небольшим увеличением объёма. Это позволяет проводить тонкое воспроизведение всех деталей лепной формы, что широко используют скульпторы и архитекторы.».
Безводный сульфат кальция в силу своих гигроскопичных свойств применяется как влагопоглотитель. Нередко с помощью специальных добавок ему в этом качестве придают дополнительные свойства. Так, осушитель Drierite, состоящий из ангидрата с добавкой хлорида кобальта, меняет свою изначально голубую окраску на розовую, что позволяет своевременно отследить момент исчерпания ресурса препарата.
Искусственные кристаллы сульфата кальция, легированные марганцем или самарием, применяются как термолюминесцентный материал.
Также находит применение в пиротехнике в качестве окислителя в осветительных составах, в смеси с алюминием или магнием в отношении гипс алюминий 1:1~2 в зависимости от требований. Используется как в порошкообразном так и в отверженном состоянии.
Сульфат кальция может применяться в качестве коагулянта, например, при изготовлении тофу.
В пищевой промышленности зарегистрирован в качестве пищевой добавки эмульгатора E516.
Регистрационный номер CAS:
- безводный 7778-18-9 ;
- семигидрат 10034-76-1 ;
- дигидрат 10101-41-4 .
Физические свойства
Безводный сульфат кальция — бесцветные кристаллы при нормальных условиях — с ромбической кристаллической решёткой, плотность 2,96 г/см³, температура плавления 1450 °C. При повышенных температурах (свыше 1200 °C) может существовать в виде стабильной кубической модификации или двух метастабильных α- и β-гексагональных модификаций. Очень медленно присоединяет воду, гидратируясь до кристаллогидрата с 1/2 или 2 молекулами воды на 1 молекулу сульфата, соответственно CaSO4 · 0,5H2O и CaSO4 · 2H2O. В воде растворим незначительно. Растворимость падает с повышением температуры: если при 20 °C она составляет 0,2036 г/100 г воды, то вблизи точки кипения воды (100 °C) снижается до 0,067 г сульфата на 100 г воды. Растворённый в природной воде сульфат кальция является одним из факторов, определяющих жёсткость воды.
Физические свойства двуводного сульфата кальция
При повышении температуры, но не более чем до 180 °C двуводный сульфат кальция теряет часть воды, переходя в полуводный — так называемый «жжёный гипс», пригодный для дальнейшего применения как вяжущее вещество. При дальнейшем нагреве до 220 °C гипс полностью теряет воду, образуя безводный CaSO4, который лишь при длительном хранении поглощает влагу и переходит в полугидрат. Если обжиг вести при температуре выше 220 °C, то получается безводный CaSO4, который влагу уже не поглощает и не «схватывается» при смешивании с водой (это вещество нередко называют «мёртвый гипс»). При дальнейшем нагревании до 900—1200 °C можно получить «гидравлический гипс», который после охлаждения вновь обретает свойства связываться с водой. Первый способ частичной дегидратиции применяют в промышленных условиях для получения полугидрата сульфата кальция (жжёного гипса, алебастра) CaSO4 ∙ 0,5H2O, нагревая дигидрат примерно до 140 °C, уравнение реакции: CaSO 4 · 2H2O = CaSO4 · 0,5H2O + 1,5H2O.
Что такое кальций?
Кальций — минерал, относящийся к группе макроэлементов, необходимых для правильного развития и функционирования организма. Макроэлементы должны поступать регулярно с пищей и в строго определенных дозах
Среднесуточная потребность в кальции составляет около 1000 мг и что немаловажно – увеличивается с возрастом.
Всасывание кальция происходит в основном в тонком кишечнике, по принципу активного транспорта. Степень его биодоступности зависит от нескольких факторов, в первую очередь от правильного функционирования гормонов, регулирующих кальциево-фосфатный баланс организма, т.е. кальцитонина и паратиреоидного гормона.
В организме взрослого человека содержится около 1,2 кг кальция, 99% локализуется в костях. Оставшийся кальций находится в ионизированной форме в плазме крови, внутри клеток, составляющих мягкие ткани и во внеклеточной жидкости. Около половины кальция, циркулирующего в крови, остается в свободной форме (в виде ионизированного кальция) и метаболически активно, в то время как остальная часть связана с белками и другими молекулами и не является биологически активной.




























