токсичность
-При попадании на кожу и в глаза может вызвать покраснение. Вдыхание может вызвать раздражение дыхательных путей и кашель. Проглатывание большого количества бензойной кислоты может вызвать желудочно-кишечные расстройства, что может привести к повреждению печени и почек.
-Бензойная кислота и бензоаты могут выделять гистамин, который может вызывать аллергические реакции и раздражение глаз, кожи и слизистых оболочек.
-Он не обладает кумулятивным, мутагенным или канцерогенным действием, так как быстро всасывается в кишечнике, выводится с мочой, не накапливаясь в организме.
-Максимальная разрешенная доза согласно ВОЗ составляет 5 мг / кг массы тела / день, примерно 300 мг / день. Доза острой токсичности для человека: 500 мг / кг.
целебный
-Это компонент мази Уитфилда, которая используется для лечения кожных заболеваний, вызванных грибками, такими как стригущий лишай и микоз. Мазь Уитфилда состоит из 6% бензойной кислоты и 3% салициловой кислоты.
-Это ингредиент в настойке бензоина, который использовался в качестве местного антисептика и противоотечного ингаляционного средства. Бензойная кислота использовалась как отхаркивающее, болеутоляющее и антисептическое средство до начала 20 века.
-Бензойная кислота использовалась в экспериментальной терапии пациентов с заболеваниями, связанными с накоплением остаточного азота.
Строение бензойной кислоты
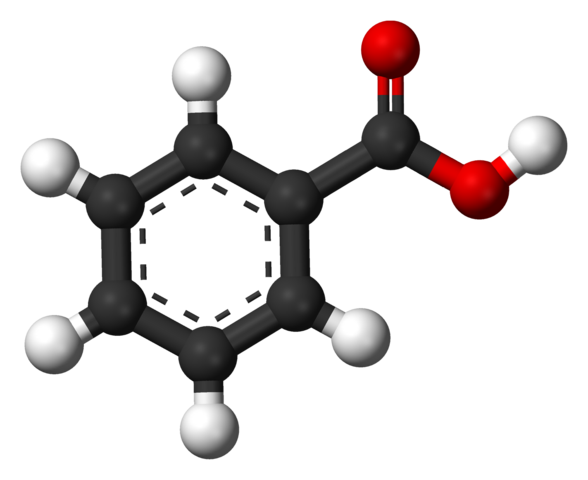
На верхнем изображении показана структура бензойной кислоты в виде стержня и сферы. Если подсчитать количество черных сфер, окажется, что их шесть, то есть шесть атомов углерода; две красные сферы соответствуют двум атомам кислорода карбоксильной группы –COOH; и, наконец, белые сферы — это атомы водорода.
Как видно, слева расположено ароматическое кольцо, ароматичность которого иллюстрируется пунктирными линиями в центре кольца. А справа группа –COOH, отвечающая за кислотные свойства этого соединения.
Молекулярно C 6 H 5 COOH имеет плоскую структуру из-за того, что все его атомы (за исключением атомов водорода) имеют sp 2 -гибридизацию .
С другой стороны, высокополярная группа -COOH позволяет постоянному диполю существовать в структуре; диполь, который можно было бы наблюдать с первого взгляда, если бы была доступна его карта электростатического потенциала.
Как следствие этого факта, C 6 H 5 COOH может взаимодействовать с самим собой посредством диполь-дипольных сил; в частности, со специальными водородными связями.
Если вы посмотрите на группу –COOH, вы обнаружите, что кислород в C = O может принимать водородную связь; в то время как кислород от ОН отдает их.
производство
Ниже приведены некоторые способы получения этого соединения:
-Большая часть бензойной кислоты производится в промышленности путем окисления толуола кислородом, присутствующим в воздухе. Процесс катализируется нафтенатом кобальта при температуре 140-160 ° С и давлении 0,2-0,3 МПа..
-Толуол, с другой стороны, может быть хлорирован для получения бензотрихлорида, который впоследствии гидролизуется до бензойной кислоты.
-Гидролиз бензонитрила и бензамида в кислой или щелочной среде может привести к образованию бензойной кислоты и ее сопряженных оснований.
-Бензиловый спирт при окислении, опосредованном перманганатом калия, в водной среде образует бензойную кислоту. Реакция происходит при нагревании или дефлегмации. После завершения процесса смесь фильтруют для удаления диоксида марганца, а надосадочную жидкость охлаждают до получения бензойной кислоты..
-Бензотрихлоридное соединение реагирует с гидроксидом кальция, используя железо или соли железа в качестве катализаторов, первоначально образуя бензоат кальция, Са (С6H5COO)2. Затем эта соль по реакции с соляной кислотой превращается в бензойную кислоту..
Биологическое действие и влияние на здоровье человека
Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике — до 0,20 % в спелых ягодах, и в клюкве — до 0,063 %. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena. Среди животных, бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренных органах и мускулах тундряной куропатки (Lagopus muta), также как и в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Ссылки
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. Амины. (10th издание.). Wiley Plus.
- Кэри Ф. (2008). Органическая химия. (Издание шестое). Мак Гроу Хилл.
- Химическая книга. (2017). Бензойная кислота. Получено с: chemicalbook.com
- PubChem. (2018). Бензойная кислота. Получено с: pubchem.ncbi.nlm.nih.gov
- Википедия. (2018). Бензойная кислота. Получено с: en.wikipedia.org
- Дадачанджи, Диншоу. (18 мая 2018 г.). Химические свойства бензойной кислоты. Наука. Получено с: sciencing.com
- Министерство труда и социальных дел Испании. (н.д.). Бензойная кислота . Международные карты химической безопасности. Получено с: insht.es
Производные
- 2,3-дигидроксибензойная кислота (пирокатехиновая кислота)
- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
- 2,5-дигидроксибензойная кислота (гентизиновая кислота)
- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
- 3,4-дигидроксибензойная кислота (протокатехиновая кислота)
- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Реакции
-При контакте с основаниями (NaOH, КОН и др.) Образует соли бензоата. Например, если он реагирует с NaOH, он образует бензоат натрия, C6ЧАС5COONa.
-Реагирует со спиртами с образованием сложных эфиров. Например, его реакция с этиловым спиртом дает этиловый эфир. Некоторые эфиры бензойной кислоты служат пластификаторами.
-Реагирует с пентахлоридом фосфора, PCl5с образованием бензоилхлорида, галогенангидрида. Бензоилхлорид может реагировать с аммонием (NH3) или амин, такой как метиламин (CH3NH2) с образованием бензамида.
-Взаимодействие бензойной кислоты с серной кислотой приводит к сульфированию ароматического кольца. Функциональная группа -SO3H замещает атом водорода в мета-положении кольца.
-Он может реагировать с азотной кислотой с использованием серной кислоты в качестве катализатора с образованием мета-нитробензойной кислоты.
-В наличии катализатора, такого как хлорид железа, FeCl3бензойная кислота реагирует с галогенами; например, он реагирует с хлором с образованием мета-хлорбензойной кислоты.
Сохранение продуктов питания
Бензойная кислота и ее соли используются для консервирования продуктов питания. Соединение способно подавлять рост плесени, дрожжей и бактерий посредством механизма, зависящего от pH.
Они действуют на эти организмы, когда их внутриклеточный pH падает до pH ниже 5, почти полностью подавляя анаэробную ферментацию глюкозы для производства бензойной кислоты. Это противомикробное действие требует pH от 2,5 до 4 для более эффективного действия.
-Используется для консервирования таких продуктов, как фруктовые соки, газированные напитки, газированные напитки с фосфорной кислотой, соленья и другие подкисленные продукты.
Benzoic acid в косметике и медицине
Существуют случаи, когда присутствие бензойной кислоты в составе кремов оправдано. Более того, она является действующим веществом. Эти продукты, как правило, профессиональные, имеют строгую рекомендацию к употреблению и должны применяться под надзором специалистов. Время выдержки на коже минимальное. Возможны покраснения, ощущения покалывания или пощипывания.
Бензойная кислота относится к слабым кератолитикам. Превышение концентрации или допустимого времени воздействия приведет к химическому ожогу. Поэтому некоторые кремы наносят очагово, точечно. Это скорее не косметика, а лекарство.
К таким продуктам относятся мази от чесотки, антигрибковые кремы, противокашлевые микстуры, средства для борьбы с акне, лаки для волос сильной фиксации, пилинги, средства для удаления веснушек.
Применение
Зарегистрированные препараты на основе бензойной кислоты разрешены к применению против болезней cвеклы сахарной (кагатные гнили).
В результате проведенных производственных испытаний установлено положительное влияние препарата на сохранность корнеплодов сахарной свеклы в условиях открытых кагатов. Выявлено, что после 20 и 40 суток хранения сырья содержание гнилой массы в среднем составило на контроле 1,85 и 3,0% – 0,9 и 1,6% к массе свеклы.
Применение препарата с рациональной нормой расхода жидкости способствовало снижению загнивания корнеплодов в сравнении с контрольным вариантом в среднем на 48,4%.Экспериментально выявлено, что обработка корнеплодов позволила снизить среднесуточные потери массы свеклы и сахара на 40,9 и 32,7%.
Рекомендации
- ↑ и
- рассчитывается молекулярная масса от .
- ↑ и (ru) Роберт Х. Перри и Дональд В. Грин , Perry’s Chemical Engineers ‘Handbook , США, McGraw-Hill,1997 г., 7- е изд. , 2400 с. ( ISBN 0-07-049841-5 ) , стр. 2-50
- (in) Карл Л. Яс, Справочник по термодинамическим диаграммам , Vol. 2, Хьюстон, Техас, паб Gulf. Co.,1996 г.( ISBN 0-88415-858-6 )
- (in) Дэвид Р. Лид , Справочник CRC по химии и физике , Бока-Ратон, CRC Press,18 июня 2002 г., 83- е изд. , 2664 с. , стр. 5-89
- ↑ и
- (in) Дж. Г. Спейт и Норберт Адольф Ланге, Справочник Ланге по химии , McGraw-Hill,2005 г., 16- е изд. , 1623 с. ( ISBN 0-07-143220-5 ) , стр. 2,289
- Клаус Вайссермель и Ханс-Юрген Арпе, Промышленная органическая химия , Под ред. De Boeck University, trad. из 3 е изд. , стр. 364 .
- ↑ и (ru) « Многофункциональность кристаллических оксидных катализаторов MoV (TeNb) M1 в селективном окислении пропана и бензилового спирта » , ACS Catal ,2013, стр. 1103-1113
- (in) Гергели Надь , Андреа Бек , Дьердь Шафран и Золтан Шай , Нанодисперсные золотые катализаторы в окислении бензилового спирта: сравнение различных материалов в различных условиях , Кинетика реакций, механизмы и катализ , Vol. 128, п о 1,1 — го октября 2019, стр. 71–95
- (в) Бен Qi , Yanbing Wang Lan Lan Lu и Ин Ян , « без растворителей аэробного окисления бензилового спирта над палладиевых катализаторов поддерживаются MnOxprepared один год с использованием метода адсорбции » , Reaction Kinetics, механизмы и катализа , Vol. 108, п о 21 — го апреля 2013, стр. 519-529
- (in) Лиминг Сан , Венвен Чжан Цзян Шан и Гоцзян Чен , « Инкапсулированный углеродом Fe3O4 для катализирования аэробного окисления бензилового спирта и бензола » , Кинетика реакций, механизмы и катализ , Vol. 126, п о 21 — го апреля 2019, стр. 1055–1065
- Джим Стивенсон и др. , Университет Саутгемптона, в The Lancet , сентябрь 2007 г. Исследование опубликовано в Le Monde , 7 сентября 2007 г.
- Репортаж из документального фильма на RTL TVI , 5 февраля 2010 г.
Лекарственные
-Это компонент мази Уитфилда, которая используется для лечения кожных заболеваний, вызванных грибками, такими как стригущий лишай и микоз. Мазь Уитфилда состоит из 6% бензойной кислоты и 3% салициловой кислоты.
-Это ингредиент в настойке бензоина, которая использовалась в качестве местного антисептика и противоотечного ингаляционного средства. Бензойная кислота использовалась как отхаркивающее, болеутоляющее и антисептическое средство до начала 20 века.
-Бензойная кислота использовалась в экспериментальной терапии пациентов с заболеваниями, связанными с накоплением остаточного азота.
Что такое бензоат натрия?
Бензоат натрия — это натриевая соль бензойной кислоты, имеющая химическую формулу C6H5COONa. Мы можем получить его по реакции нейтрализации бензойной кислоты. Этот способ производства включает реакцию между гидроксидом натрия и бензойной кислотой. Но в промышленных масштабах мы можем производить его также путем частичного окисления толуола в присутствии кислорода. Обычно бензоат натрия присутствует во многих пищевых продуктах вместе с бензойной кислотой. Некоторые богатые источники находятся среди овощей и фруктов. Основное применение этого соединения — его использование в качестве пищевого консерванта.

Бензоат натрия имеет молярную массу 144 г / моль. Он выглядит как белый кристаллический порошок без запаха. Температура плавления этого соединения 410 ° C.
Описание, физические свойства соединения
При комнатной температуре бензойная кислота выглядит как белый порошок. Если рассмотреть его под микроскопом, вы увидите, что кристаллы имеют форму игл или чешуек (табличек). Соединение обладает резким специфическим запахом. Химическая формула этой карбоновой (органической) кислоты – C6H5COOH или C7H6O2. При нагревании до 122,4 ⁰C она начинает плавиться, а при 249 ⁰C — кипеть, дальнейшее повышение температуры до 370 ⁰C приведёт к термическому разложению. Нетрудно подсчитать молярную массу соединения, она составляет 122,12 грамм/моль. Реагент очень плохо растворяется в воде, а в этаноле и эфирах — хорошо. Реактив C6H5COOH является слабой кислотой, константа её диссоциации составляет 4,202.
Общая информация
С точки зрения химии добавка Е-210 — это карбоновая кислота, относящаяся к классу простейших одноосновных кислот ароматического ряда. Химическая формула бензойной кислоты: C7H6O2 (C6H5COOH).
С физической точки зрения бензойная кислота представляет собой кристаллический порошок белого цвета с характерным запахом. Добавка Е-210 плохо растворима в воде, из-за чего вместо бензойной кислоты чаще всего применяется бензоат натрия (пищевая добавка E-211). В то же время добавка Е-210 достаточно хорошо растворима в диэтиловом эфире и этаноле.
Впервые бензойная кислота была получена методом сублимации в 16 веке из росного ладана (бензойной смолы). Отсюда бензойная кислота и получила своё название. В 1832 году немецким химиком Юстусом фон Либихом была определена структура бензойной кислоты, а также исследованы ее свойства и связь с гиппуровой кислотой. В 1875 были обнаружены и изучены антигрибковые свойства бензойной кислоты, в результате чего она долгое время применялась при консервировании фруктов.
В промышленности добавку Е-210 получают методом окислением толуола (метилбензола) при участии катализаторов. Этот процесс использует дешевое сырье и считается экологически чистым.
Бензойная кислота хорошо всасывается организмом человека и в виде гиппуровой кислоты (взаимодействуя с белковыми соединениями) выводится через почки. Существуют обоснованные опасения, что пищевые добавки Е-210 и E-211 могут вступать в безалкогольных напитках в реакции с аскорбиновой кислотой (витамин С, добавка E-300) с образованием свободного бензола, который является сильным канцерогеном. Поэтому рекомендуется избегать употребления напитков, в которых содержаться эти добавки одновременно.
Что такое Е210
Это бензойная кислота, внешне имеющая вид кристаллического порошка. Такое название это вещество унаследовало от бензойной смолы. В природе кислота находится в бруснике, вешенках, клюкве и горьком миндале. Е 210 применяется для получения большого количество органических веществ. Соли этой кислоты имеют названия бензоаты.
Вот какие свойства имеет это вещество:
- оттенок – белый или желтоватый;
- в нормальных условиях имеет вид прозрачных кристаллов;
- запаха у нее нет;
- плохо растворяется в воде, хорошо – в спирте.
На пищевые предприятия и в оптовую торговлю поступает в больших картонных мешках (до 25 кг).
Действие на вредные организмы
Бензойная кислота оказывает сильное угнетающее действие на плесневые грибы, бактерии и дрожжи, в частности, обладает значительным эффектом обеззараживания по слизеобразующим мезофиллам и плесневым грибам.
Помимо дезинфицирующих свойств, вещество тормозит физиологические процессы, в частности, интенсивность дыхания и прорастания урожая свеклы. За счет снижения интенсивности дыхания уменьшается количество проросших и загнивших корнеплодов свеклы.По данным из литературных источников, препарат Кагатник способствует уменьшению интенсивности дыхания на 12 мг СО2/г•ч (или на 24%).
Защитное действие препарата продолжается 90–120 дней.
Температурный оптимум Кагатника находится в диапазоне от 0 до 5°С, т.е. полностью совпадает с наилучшей температурой для хранения корнеплодов свеклы. При ее повышении препарат полностью сохраняет свое антисептическое действие, поскольку отдельные углеводороды, входящие в его состав, переходят в газообразное состояние и действуют на микромицеты более активно. Однако из-за интенсивной диссоциации действующих веществ целесообразно повышение концентрации препарата при формировании кагата.
Механизм действия. Препарат «Кагатник» на основе бензойной кислоты имеет отличный от других фунгицидов механизм действия: он подавляет в клетках активность ферментов, которые расщепляют сахара, а также ферментов, отвечающих за окислительно-восстановительные реакции.
Как указывалось выше, карбоциклические углеводороды действуют не только на патогенную микрофлору, но и на корнеплоды, минимизируя интенсивность дыхания последних за счет интенсивной суберинизации поврежденных паренхимных тканей.
Возгонка
Реактив легко поддаётся возгонке. При этом кристаллы сублимируются из паров, минуя жидкую фазу. Такой переход легко проследить при помощи опыта «зима в стакане» или «искусственный снег». Для этого в термостойкую химическую посуду помещают небольшое количество реагента и еловую веточку. Сверху располагают круглодонную колбу с водой, она послужит холодильником и крышкой. Конструкцию устанавливают на штатив и подвергают нагреванию. При этом реактив начинает возгоняться. Пары, достигая колбы с холодной водой, кристаллизуются и превращаются в «снег». Они оседают на еловой ветке и стенках стакана в виде тоненьких иголочек. Потрясающее зрелище! У него есть и практическое применение – сублимацию используют для получения и бензойной кислоты.
Безопасность продуктов
Конечно, безопасность достигается далеко не только за счёт Е-шек, здесь много факторов влияют на продукт: тепловая обработка, упаковка, гигиена. Но и в употреблении пищевых консервантов там, где это уместно и разумно, нет ничего зазорного. И часто производители в ущерб себе убирают консерванты, чтобы не пугать покупателей, боящихся «химии». И, таким образом, делают продукт менее безопасным.
Это печально. Потому что наука шла десятилетиями к тому, чтобы еда была безопасной, вкусной и полезной. А мы это отметаем, будто хотим вернуться в средневековье, когда было безопаснее пить пиво, чем воду, а мясо и рыба кишели паразитами.
Бактерии, плесень и токсины, которые они производят… Всё это мы не хотели бы встретить в нашей еде. Для того, чтобы продукты не испортились слишком быстро, мы и используем консерванты — разновидность Е-добавок. (Подробнее про то, что такое Е-добавки, откуда взялись и что с ними делать — читайте в нашей статье).
Важно отметить: Е-код присваивается именно тем веществам, которые неоднократно подтвердили свою безопасность для человека. Все Е-добавки регулярно, постоянно проверяют
Это чуть ли не самый изученный продукт современной пищевой науки.
Если интересно, всегда можно почитать правила, по которым проверяют пищевые добавки на безопасность, изучают их токсичность и как часто надо делать переоценку.
Незаменимый консервант
Рассматривая этикетки пищевых продуктов, вы часто сталкиваетесь с компонентами, закодированными буквой Е. Под этой маркировкой кроются различные красители, ароматизаторы, эмульгаторы, консерванты и усилители вкуса. Бензойную кислоту можно встретить под кодом Е210. Эта пищевая добавка является натуральным консервантом, который вырабатывается в кисломолочных продуктах естественным путём. В природе соединение можно встретить в различных частях растений, смолах, бобровой струе. Используют Е210 при изготовлении пищевых продуктов – соусов, супов, желе, консерваций, напитков. Поскольку компонент мало растворим в воде, чаще берут соли бензойной кислоты, например, бензоат натрия с кодом Е211.

Избыток и недостаток
Передозировка бензойной кислотой ухудшает работу печени, почек, легких, вызывает проблемы с психикой. У человека наблюдаются признаки астмы, аллергическая реакция (отек, высыпания), нарушается работа щитовидной железы.
Дефицит кислоты в организме вызывает расстройство пищеварительного тракта, головные боли, депрессию. У человека нарушается обмен веществ, возникает слабость, раздражительность, волосы становятся ломкими. В результате длительной нехватки «природного консерванта» наступает анемия.
Потребность организма в соединении снижается при низком уровне свертываемости крови, в состоянии покоя, при патологиях щитовидной железы и увеличивается при аллергии, сгущении крови, инфекционных заболеваниях.
Интересно, что бензойная кислота (в пределах нормы) улучшает выработку молока у кормящих женщин.
Пищевые добавки

Пищевые добавки
Пищевые добавки в современное время пользуются востребованностью среди людей. Ведь как просто, не нужно следить за диетой, рассчитывать дневную норму и «париться».
К ним обращаются спортсмены, которые хотят «нагнать» мышечную массу, иметь рельефное тело. Предложение привлекательное, но можно попасться на подделку, неоригинальный товар, обман, обещающий быстрый результат. А при избыточном потреблении – неполадки в организме. Или наоборот, в добавках недостаточно необходимых элементов, а человек введен в заблуждение.
Таким образом, применяя пищевые добавки, стоит делать ставку на сбалансированный и полный рацион, богатый полезной пищей и необходимыми элементами. Это позволит быть здоровыми, уменьшить риск развития заболеваний, не чувствовать усталости и слабости.
Человек обретает силы, уверенность и красоту. Здоровье – главная часть жизни, нужно научиться заботиться о нем, прислушиваться и обеспечивать всем, что он требует. А аминокислоты – та часть питания, которую следует обязательно включать в рацион и придерживаться суточной нормы. Особенно это касается растущего организма, который находится на пике формирования всех систем.
Более подробно об аминокислотах можно узнать из видео.
Характерные химические реакции
Бензойная кислота, химические свойства которой напрямую зависят от присутствия ароматического кольца, вступает в реакции электрофильного замещения. Причём более подвержен им третий атом углерода, расположенный в равном удалении от карбоксильной группы. Гораздо медленнее протекает замещение в —COOH. Для C6H5COOH характерны те же взаимодействия, что и для карбоновых кислот. При реакции этерификации (со спиртами) образуются эфиры, имеющие приятный аромат. Как и все органические соединения, бензойная кислота сгорает с выделением CO2 и воды. Взаимодействия с основаниями и металлами протекают по карбоксильной группе с образованием солей – бензоатов. Дегидрирование приводит к получению циклоалканов. Характерной химической реакцией (качественной) на C6H5COOH является выделение бензоата железа (III). Он выпадает в виде желтовато-розового осадка вследствие взаимодействия бензойной кислоты с FeCl3.
Выводы
Сейчас у нас есть наука, технологии, мы научились сохранять пищу, используя, в том числе, то, что нам даёт природа — натуральные консерванты. Или синтезируем с лаборатории безопасные вещества для консервации.
Учёные и производственники — не злодеи и не дураки. Они «сыплют добавки» не для того, чтобы испортить вам жизнь, здоровье и «всех отравить». Никто не кладёт консерванты в пищу бесконтрольно или «просто так, побольше».
Если в продукте есть консерванты, значит, производитель позаботился о безопасности потребителя, сохранив продукт свежим и сильно снизив риск отравления.
Консерванты — наши друзья, а вовсе не враги. То, что мы научились их применять и защитить нашу еду от микроорганизмов — это большое достижение науки.
Не бойтесь химии. Бойтесь невежества! Это то, что действительно может навредить.




























